血液瘤领域治疗优势凸显。在众多免疫细胞疗法中,进展最快、发展最为成熟的是CAR-T 疗法,目前已有6 款产品获FDA 批准上市,2 款产品于国内上市。药明巨诺产品倍诺达®凭借75.9%的最佳客观缓解率以及51.7%的最佳完全缓解率,在血液瘤领域治疗优势凸显;科济药业产品CT041客观缓解率为61.1%,远优于化疗药物(vs 4%~8%),攻坚实体瘤同样未来可期。
血液瘤领域治疗优势凸显。在众多免疫细胞疗法中,进展最快、发展最为成熟的是CAR-T 疗法,目前已有6 款产品获FDA 批准上市,2 款产品于国内上市。药明巨诺产品倍诺达®凭借75.9%的最佳客观缓解率以及51.7%的最佳完全缓解率,在血液瘤领域治疗优势凸显;科济药业产品CT041客观缓解率为61.1%,远优于化疗药物(vs 4%~8%),攻坚实体瘤同样未来可期。
本报告主要研究以下问题
免疫细胞疗法概述
CAR T技术原理及构建
副作用、抗药性及其应对
总结
报告作者:复创投资医药组
2022/7
免疫细胞疗法概述
2017年是全球免疫细胞疗法的元年,来自诺华(Kymriah)、吉利德(Yescarta)的2款CAR-T产品相继问世。2022年开春伊始,国内也相继迎来了众多重磅喜讯:传奇生物开发的西达基奥仑赛成功在美国获批,成为中国首个获FDA批准及全球第二款靶向BCMA的CAR-T产品;药明巨诺的瑞基奥仑赛注射液用于治疗复发或难治性滤泡淋巴瘤患者的新适应症上市许可申请获NMPA受理;科济药业自主研发的产品CT041获国家药监局批准,进入确证性Ⅱ期临床试验,这是全球首个且唯一进入到确证性Ⅱ期临床试验、针对实体瘤的CAR-T在研产品。
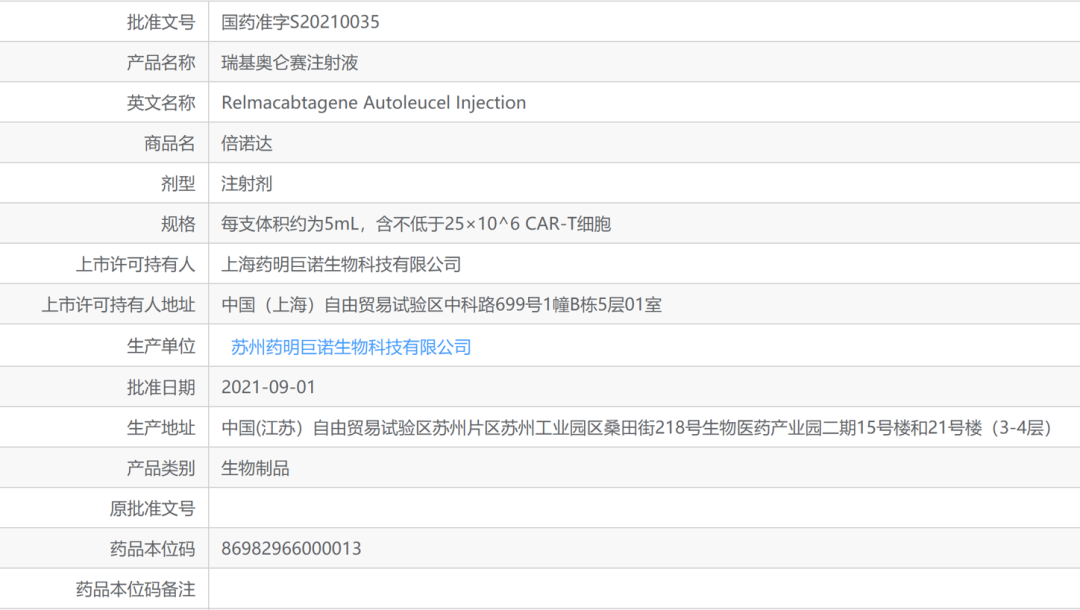
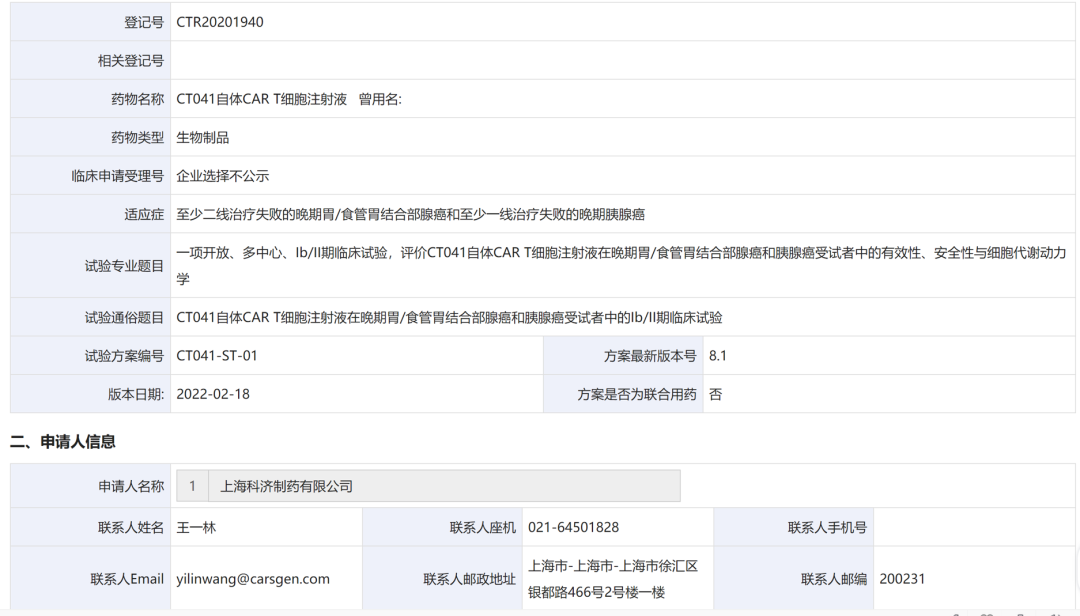
免疫细胞疗法概述
免疫细胞疗法是通过采集人体自身免疫细胞如T细胞、NK细胞、B细胞和DC细胞等,经过体外改造、培养,使其数量扩增倍或增加其靶向杀伤能力,然后再回输到患者体内,打破免疫耐受的同时,激活增强机体免疫力,达到杀灭血液及组织中病原体、肿瘤细胞的目的。
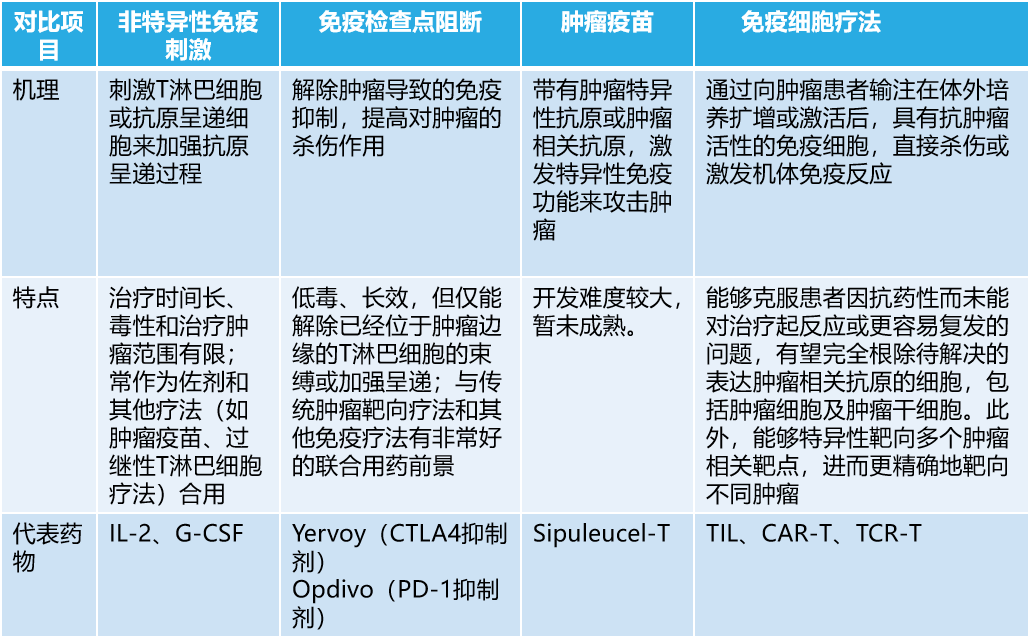
肿瘤的免疫治疗可被分为非特异性和肿瘤抗原特异性两大类。其中,非特异性肿瘤治疗主要是非特异性免疫刺激和免疫检验点阻断;而特异性肿瘤治疗则包括肿瘤疫苗和免疫细胞疗法。
这四类疗法的机理及特点如下表:
免疫细胞疗法发展历程
免疫细胞疗法最早可追溯至1976年科学家Morgan利用白介素-2(IL-2)诱导LAK(Lymphokine Activated Killer)细胞治疗黑色素瘤、肺癌等多种恶性肿瘤。之后,历经TIL、CIK等疗法,最终迎来了新一代CAR以及TCR技术,临床显示二者在抗肿瘤领域具有卓越的治疗效果。随2017年8月FDA批准诺华用于治疗急性淋巴细胞白血病的Kymriah上市,免疫细胞疗法正式进入高速发展阶段。

资料来源:医药魔方
CAR T技术原理及构建
CAR T 结构
CAR(chimeric antigen receptor),称为嵌合抗原受体,是一种合成结构。
CAR的细胞外部分通常来源于抗肿瘤抗原的抗体的轻链可变区(VL)和重链可变区(VH)构成,称为ssFv(single-chain variable fragment)。
这两个结构域之间的连接区(Linker)通常来源于重复的甘氨酸和丝氨酸残基。
第一代CAR将该抗体识别结构域ssFv,通过铰链结构域(Spacer or Hinge)、跨膜区(图中绿色段)与细胞内CD3ζ链的一部分连接起来。CD3ζ中包含3个免疫酪氨酸激活基序ITAM,因此,在没有来自TCR-CD3复合物的情况下,仅此链可传递第一活化信号。
跨膜区通常由CD8或CD28的一段序列构成。
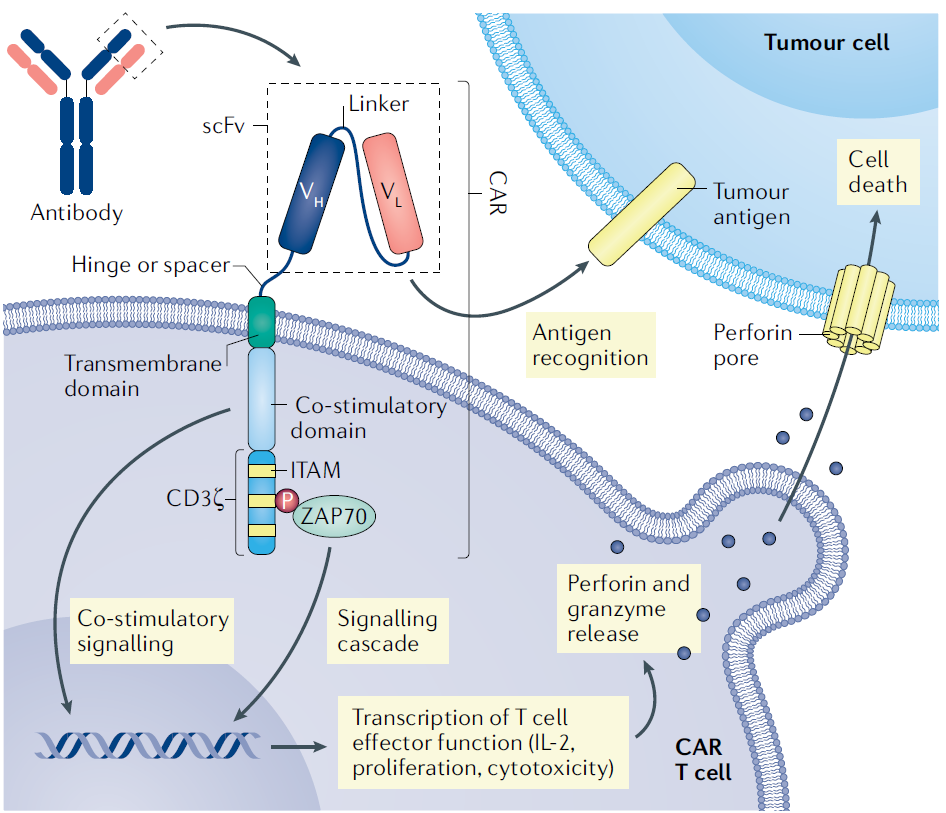
此后不久,第二代和第三代CAR架构兴起,包含了共刺激结构域(蓝色),如CD28、CD137(也称为4-1BB)、CD27、OX40和可诱导细胞共刺激因子(ICOS),模拟正常T细胞的TCR识别APC提呈的抗原期间提供的共刺激。目前所有FDA批准的CAR T细胞产品都是采用CD28或4-1BB作为共刺激结构域的第二代产品。
如果在一个产品中包括两个共刺激结构域的组合,则可认为是第三代产品。第四代或第五代CAR T细胞:产生额外的细胞因子,提高杀瘤能力,在一定程度上克服免疫微环境的影响。
CAR与癌细胞表面的抗原(目前的靶点是CD19、CD22、BCMA)后,通过其胞内段的CD3ζ链上的ITAM的磷酸化,引发细胞内一系列信号转导,引起各种基因表达的增加,表现在T细胞的增殖、细胞因子释放、代谢改变和细胞毒性的显现(如图示中的穿孔素和颗粒酶)。
CAR T 杀瘤机理
正常T细胞在行使杀伤作用前会与靶细胞结合,并在结合区形成免疫突触。同样地,CAR-T细胞也会靶向肿瘤细胞,并通过基因修饰的CAR结构与靶细胞形成类似的免疫突触并启动免疫反应。其主要通过以下三种机制杀伤肿瘤细胞:
① CAR-T细胞分泌穿孔素和颗粒酶,穿孔素可以在肿瘤细胞表面“打洞”,随后颗粒酶被输送至肿瘤细胞内部,通过物理作用直接杀伤肿瘤细胞或诱导肿瘤细胞发生凋亡;
② CAR-T细胞表面会高表达TNF(肿瘤坏死因子)配体,这些配体可以诱导肿瘤细胞凋亡;
③ CAR-T细胞会分泌特定的细胞因子,这些细胞因子可以加强CAR-T细胞的活性,进而改变肿瘤微环境,增强抗肿瘤活性。
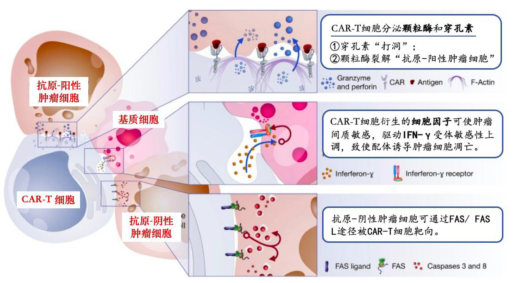
资料来源:《Killing Mechanisms of Chimeric Antigen Receptor (CAR)TCells》(Mohamed-Reda Benmebarek等)
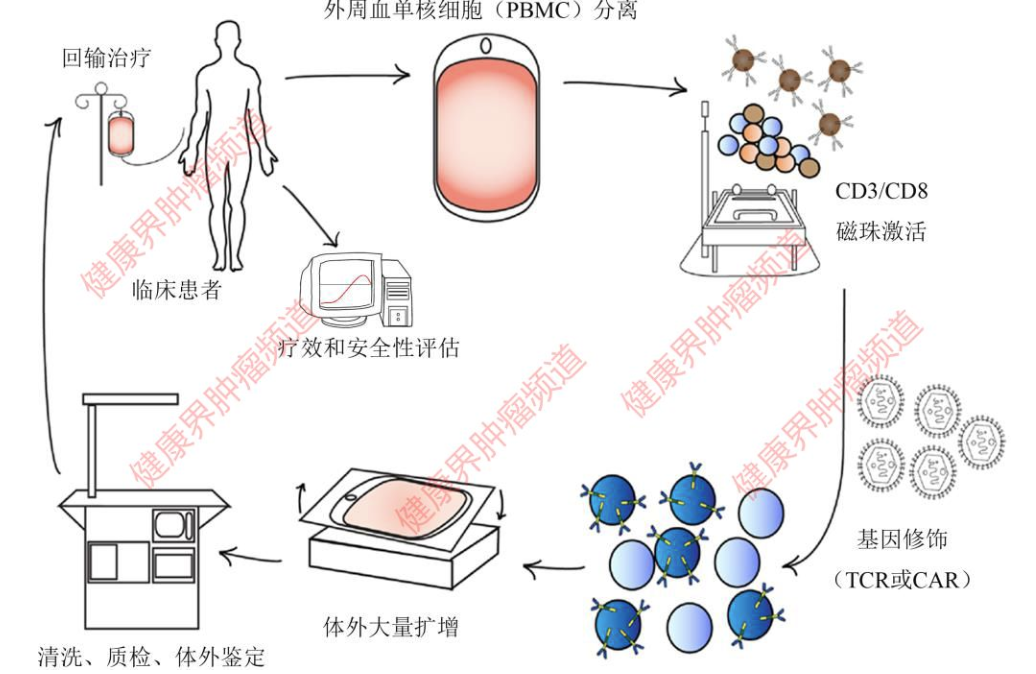
CAR T细胞的生产流程
(1)CAR T细胞的制造通常始于患者的白细胞分离。FDA批准的CAR T细胞来源于患者自身的细胞,可避免同种异体排斥或移植物抗宿主病(GvHD, graft-versus-host disease)问题,但需要个体定制。
(2)然后通过刺激和共刺激体外激活T细胞,分别通过它们的TCR(CD3)和选择的配体(通常是CD28)在细胞因子的存在下进行。
(3)激活后,CAR构建体通常通过病毒载体引入T细胞。通常使用的载体是逆转录病毒和慢病毒载体,随机整合到宿主T细胞中基因组中。(4)最后,CAR T细胞在生物反应器中以天为单位生长,然后输送回患者。通常,CAR T细胞以单次注射,或有时在2或3天内分开注射。
副作用、抗药性及其应对
副作用:CRS与神经毒性的机理
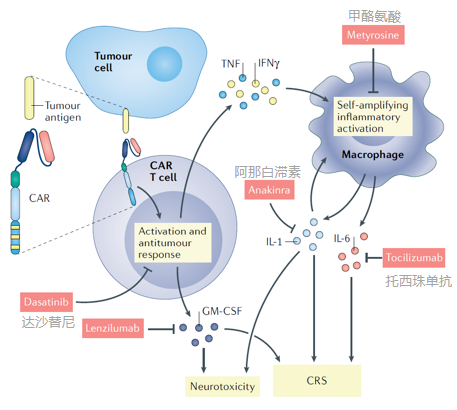
与CAR T细胞治疗相关的两个标志性临床毒性是CRS(cytokine release syndrome,细胞因子释放综合征)和神经毒性。
CRS通常在CAR T细胞治疗的第一周内表现为发热、低血压和呼吸功能不全,血清细胞因子水平较高。神经毒性表现为暂时性工作记忆丧失、谵妄(意识障碍、行为无章、没有目的、注意力无法集中)、癫痫发作以及罕见的急性脑水肿。
引发CRS的机理:一旦识别出肿瘤抗原,CAR T细胞通过分泌炎性细胞因子,如粒细胞-巨噬细胞集落刺激因子(GM-CSF)、肿瘤坏死因子(TNF)和干扰素-γ(IFN-γ),导致固有免疫细胞活化。巨噬细胞(一种固有免疫细胞)通过释放白细胞介素-1(IL-1)和IL-6,导致炎症反应的自我放大闭环。
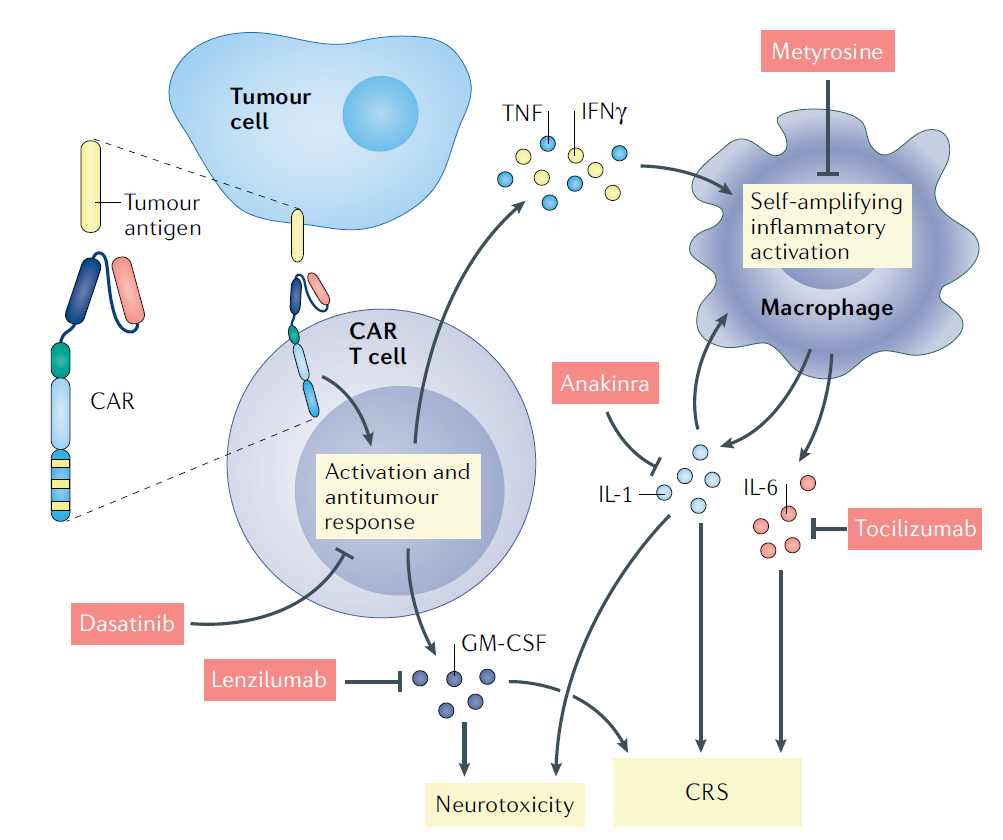
神经毒性与高水平的促炎细胞因子(IL-6、IL-8、CC趋化因子配体2(CCL2)和CXC趋化因子配体10(CXCL10))有关。在脑脊液(CSF, cerebrospinal fluid)中,血-脑脊液屏障破坏的证据与神经毒性等级相关。尽管如此,神经毒性的机制目前尚不清楚。
有研究推测促炎细胞因子的增加可能激活脑血管系统中的内皮细胞,从而导致通透性增加和毛细血管渗漏(称为血管源性水肿)的区域,表现为局部水肿和神经毒性。
CRS与神经毒性的治疗方法
目前临床上针对CRS和神经毒性的主要治疗方法是使用单克隆抗体阻断,以打破细胞因子的反馈回路:GM-CSF(lenzilumab)、IL-6(托西珠单抗tocilizumab)和IL-1(Anakina)。皮质类固醇也经常与托西利珠单抗联合使用,以减少大脑中的炎症和血管源性水肿。
敲除CAR T细胞的GM-CSF的基因也可以限制CRS和神经炎症。
另外,酪氨酸激酶抑制剂达沙替尼影响T细胞信号以减少CRS,而甲酪氨酸抑制剂巨噬细胞炎症激活以达到类似效果。
抗药性:抗原丢失及其应对
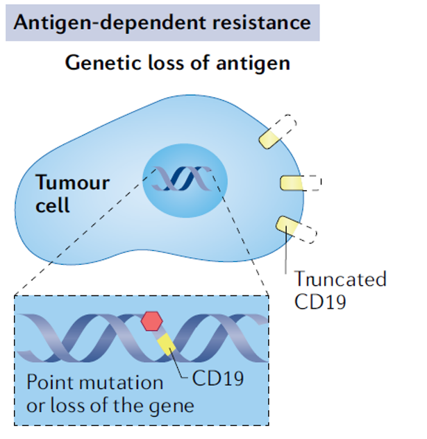
CAR T细胞治疗后复发的常见机制之一是抗原丢失。大部分抗原丢失是因选择性压力导致肿瘤细胞的CD19的基因发生点突变或丢失,这样肿瘤细胞不再表达CD19或表达一个变化了的CD19。
应对:开发其他靶点或双靶点的CAR T,目前很多临床中的CAR T都已经选择了CD20和CD22作为双靶点。
1.抗药性:T细胞衰竭
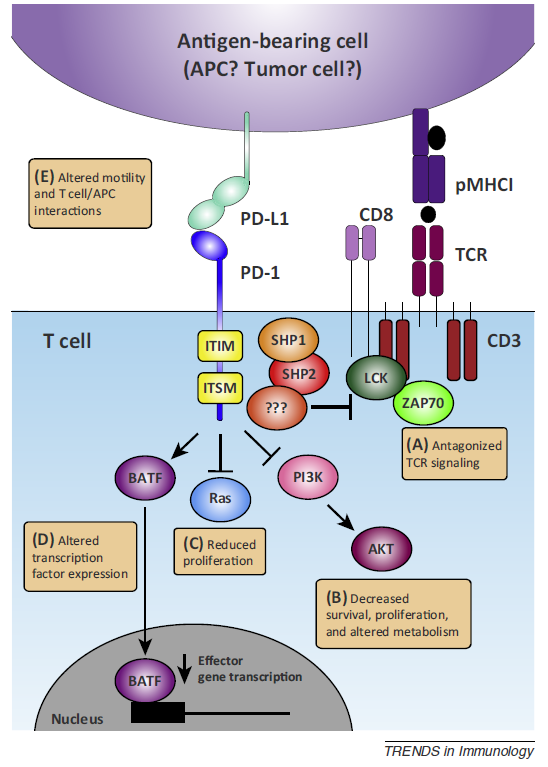
由于长期暴露于持续性抗原和炎症,T 细胞逐渐失去效应功能,记忆T细胞特征也开始缺失,称为 T 细胞耗竭(T Cell Exhaustion)。
T细胞衰竭的一个主要特征是多个抑制性受体的过度表达,包括PD-1(CD279)、细胞毒性T淋巴细胞抗原-4(CTLA-4、CD152)、淋巴细胞活化基因3(Lag-3)、T细胞免疫球蛋白结构域和粘蛋白结构域3(Tim-3)、CD244/2B4、CD160、以及具有Ig和ITIM结构域的T细胞免疫受体(TIGIT)等,并伴有转录谱改变,代谢方式改变等现象。
T细胞衰竭是正常的生理现象,因为人体内的T细胞在经过一番抗原刺激增殖后,需要表达一些负调控的“细胞开关”,等待一些具有免疫负调控的细胞因子的负调控,从而发生凋亡,但是对于治疗肿瘤来说,这种负调控会大大降低CAR T的杀瘤能力。
2.T细胞衰竭的应对
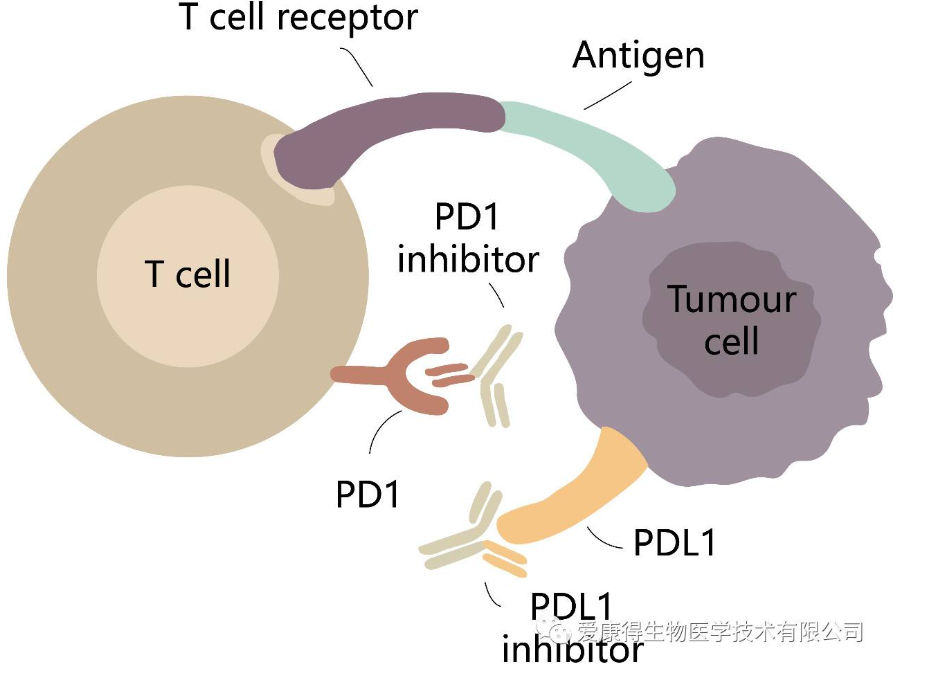
通过联合使用负调控配体的单抗,阻断T细胞负调控的通路,如阻断PD1–PDL1通路可以克服肿瘤中PDL1表达对T细胞的抑制。FDA对PD1和PDL1单克隆抗体的批准,在肿瘤学方面取得了巨大的临床成功。
另外一个思路是通过脂质体或外泌体载micro-RNA的方式,在mRNA水平降低其负调控膜蛋白的表达(如PD-1,CTLA-4等)。
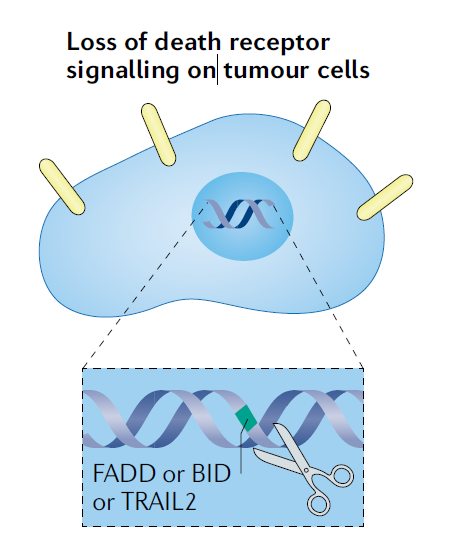
抗药性:死亡受体通路受损
目前已确定死亡受体通路受损是靶向CD19的CAR T细胞治疗耐药的另一种机制。肿瘤细胞中FADD(FAS-associated death domain protein, FAS相关的死亡结构域蛋白)、BID(BH3-interacting domain death agonist,BH3互做结构域死亡激动剂)和TRAIL2(tumour necrosis factor-related apoptosis-inducing ligand 2,肿瘤坏死因子相关凋亡诱导配体2)的缺失使其对CAR T细胞的功效更具抵抗力。
1.抗药性:肿瘤微环境
当面对实体肿瘤时,抑制性肿瘤微环境(tumour microenvironment, TME)也可能产生对CAR T细胞治疗的耐药性。缺乏吸引CAR T细胞的趋化因子、异常的血管系统和产生细胞外基质的癌相关成纤维细胞都会使CAR T细胞难以接近实体肿瘤。即使接近,Treg细胞、髓源性抑制细胞(myeloid-derived suppressor cells, MDSC),转化生长因子-β(TGFβ),IL-6,IL-10和前列腺素E2(PGE2),会抑制CAR T细胞的功能。
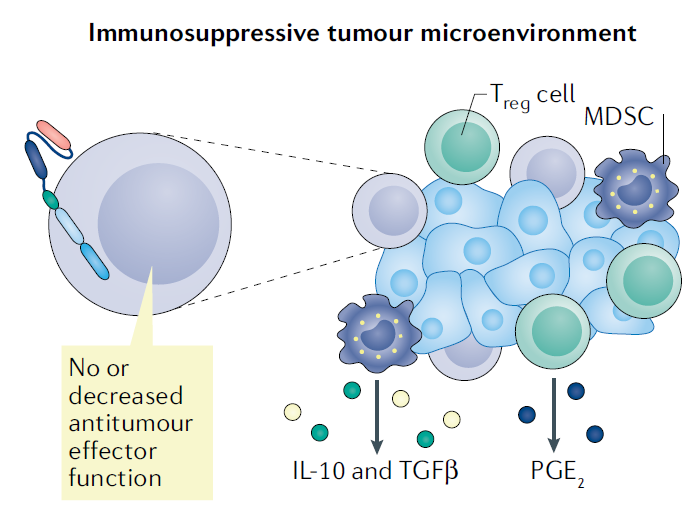
2.肿瘤微环境的应对
(1)一种策略是通过分泌促炎性可溶性因子来增加CAR T细胞的反应(第四代CAR T)。在CAR T细胞中过度表达IL-7和CCL19是淋巴器官中形成T细胞区所必需的,可增加促炎性树突状细胞(DC)和T细胞向实体瘤组织的浸润,目前该方法已经使得小鼠模型中的肿瘤消退。过度表达促炎性细胞因子如IL-12和IL-18的CAR T也被证明能激活更多的促炎性固有免疫细胞并增强抗肿瘤反应。
(2)另一个策略是阻断癌细胞发出的负调控分子(如TGFβ)。在前列腺癌中,在靶向PSMA(prostate-specific membrane antigen,前列腺特异性膜抗原)的CAR的载体中转导TGFβR(TGFβ受体)作为第二个转基因,该基因表达出来的TGFβR可以结合肿瘤微环境中高局部水平TGFβ,这样就限制了其免疫抑制效应。这种特殊的CAR结构目前正在进行一期临床试验(NCT03089203)。类似地,通过CRIPSR–Cas9技术敲除CAR T细胞中内源性的TGFβRII,表现出更高的疗效和更少的耗竭。
总结
CAR-T 细胞疗法方兴未艾
血液瘤领域治疗优势凸显。在众多免疫细胞疗法中,进展最快、发展最为成熟的是CAR-T 疗法,目前已有6 款产品获FDA 批准上市,2 款产品于国内上市。药明巨诺产品倍诺达®凭借75.9%的最佳客观缓解率以及51.7%的最佳完全缓解率,在血液瘤领域治疗优势凸显;科济药业产品CT041客观缓解率为61.1%,远优于化疗药物(vs 4%~8%),攻坚实体瘤同样未来可期。
因此在以下两个方面是我们未来关注的重点:
CAR-T的结构:
目前已经获批和正在临床中的CAR T产品,大部分为第三代和第四代CAR T结构以及双靶点等设计,未来我们将重点关注除CAR结构外,还能导入使得T细胞能够显著克服免疫微环境的能够产生多个细胞因子的CAR-T产品,也期待这类产品对实体瘤有比较好的疗效。
副作用和耐药性:
副作用方面,CRS是与T细胞增殖释放细胞因子正相关的,目前已经有较好的方法来治疗;神经毒性产生的机理科学界还没有定论,这块也只能对症治疗。随着基础科学的进步,相信这个问题也能解决。耐药性方面,我们将重点关注能够有效解决T细胞衰竭、死亡受体通路受损和肿瘤微环境对T细胞杀瘤能力抑制的产品。
文章来源:复创投资






