PROTAC(Proteolysis targeting chimeras)作为新兴的靶向降解特定靶标蛋白的技术已经受到国内外很多大药厂的热捧,并且也为肿瘤等相关的疾病的治疗带来了新的希望。传统的PROTACs主要是降解细胞内的靶点,但是近年来逐渐发展的一些抗体和PROTACs概念相结合的技术使得靶向膜表面蛋白的降解成为可能,如LYTACs(Lysosome-targeting chimaeras)和AbTACs(antibody-based PROTACs)等。此前,我们推送过抗体+PROTAC的星星之火是否会有燎原之势?一文,感兴趣的读者可以再次回顾。
最近,来自于Genentech和加利福尼亚大学的研究者分别在顶级期刊Nature和Nature Biotechnology发表了基于抗体的PROTACs技术PROTABs(proteolysis-targeting antibodies)和KineTACs(cytokine receptor-targeting chimeras)。其中PROTABs是利用双抗分别靶向细胞表面的泛素化连接酶和肿瘤靶点从而利用泛素化多目标蛋白进行降解;而KineTACs是通过双特异抗体分别靶向细胞因子受体和靶点蛋白,利用细胞因子受体介导的内吞,最终实现对细胞膜表面和分泌的靶标蛋白的降解。
PROTABs结构如下图所述,其实质上为双特异抗体,其中一个Fab结合细胞表面的泛素化连接酶,另外一个Fab结合目标蛋白,双特异抗体同时与两个靶点结合后,在E3泛素化连接酶的作用下,对目标蛋白进行泛素化并最终进入溶酶体进行降解。
图1:PROTABs的结构[1]
在E3连接酶的选择上,Genentech的研究者选择了RNF43和ZNRF3,因为其可以降低细胞中的Wnt信号(Wnt 信号通路与其他的数条信号系统一起调控胚胎发育, 维持成体组织细胞自我更新平衡。Wnt 信号系统激活物突变,抑制物功能消失,导致肿瘤干细胞自我更新失控,过度增殖,分化成熟障碍,是各分化阶段肿瘤形成的主要原因),并且研究者也在Wnt激活的肿瘤模型中证实了RNF43和ZNRF3具有较高水平的表达。
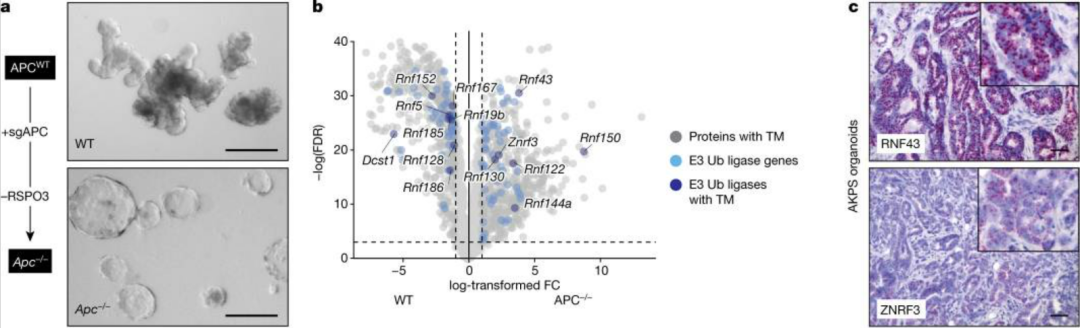
图2:RNF43和ZNRF3在肿瘤中高表达[1]
在前期概念的验证基础上,Genenetech的研究者筛选了针对,RNF43和ZNRF3的抗体,并将这些抗体和靶向IGF1R的单克隆抗体cixutumumab (Cixu)组合成双特异抗体(PROTABs)。这些抗体对IGF1R的降解与PROTABs双抗与RNF43或者ZNRF3的结合能力有关,亲和力越高,PROTABs双抗的降解能力越强。与IGF1R单抗cixutumumab (Cixu)相比,PROTABs在较低的浓度下即可有效的降解IGF1R。图3:对RNF43或者ZNRF3亲和力影响PROTABs的降解能力[1]
在小鼠肿瘤模型中,PROTABs同样可以有效的降解IGF1R。但是在正常的小鼠,或者正常的类器官模型中,PROTABs不会对IGF1R进行降解,具有较高的选择性,因此在临床的应用中可能会具有较好的安全性。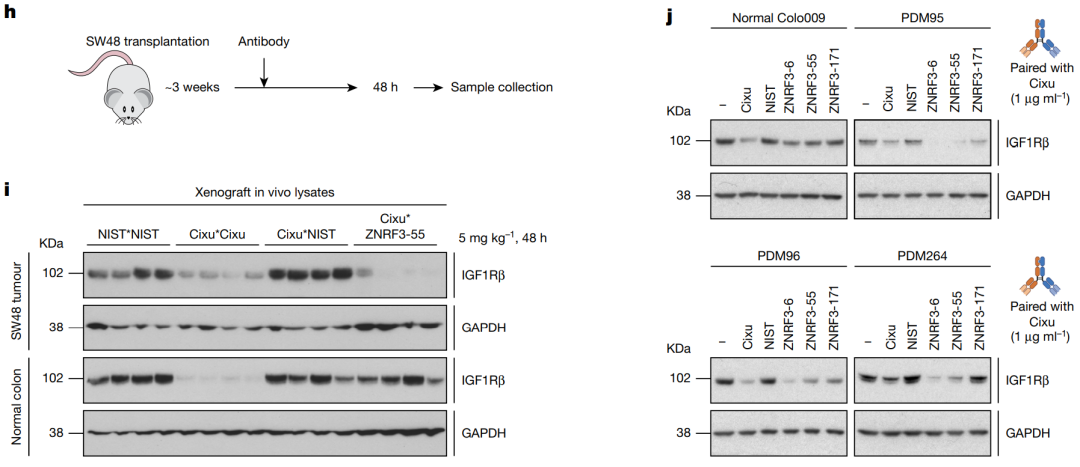
图4:小鼠肿瘤模型中PROTABs对靶标的降解[1]
在结构上,除了对PROTABs的功能进行了详细研究,研究者构建了不同了结构的PROTABs,包括1+1,2+1,1+2和单臂1+1型。这些PROTABs在降解靶标IGF1R具有不同的能力,而其中以单臂1+1型具有最强的效果,这可能在同一臂上,可以增强泛素化酶对IGF1R的泛素化。图5:PROTABs结构影响其对靶标的降解[1]
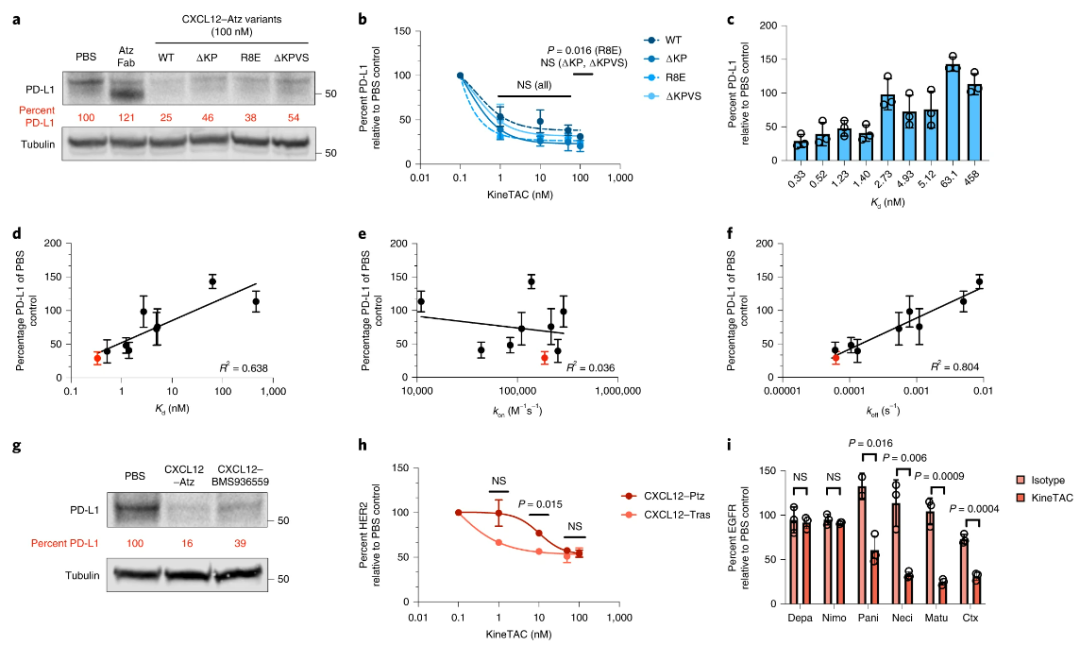
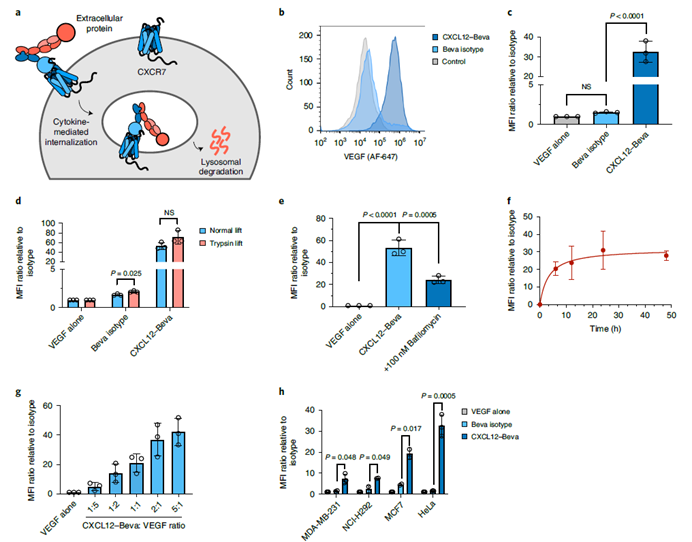
KineTACs严格意义上来将并不是双特异抗体,其是抗体与融合的蛋白相结合的双功能药物。其主要是通过KineTACs上的细胞因子和细胞表面的受体结合,通过抗体Fab和靶标结合并形成复合物,该复合物在细胞因子内吞的作用下进入细胞,并在细胞中的溶酶体降解。因此在细胞因子的选择上,需要其配体具有内化功能如CXCL12,因为其的配体CXCR7和CXCR4可以被G蛋白或者β-抑制素募集而内化。当然除了CXCL12外,研究者也鉴定出一些其它细胞因子,如CXCL11,vMIPII和IL-2等也可以用于KineTACs的构建并介导靶标蛋白的降解。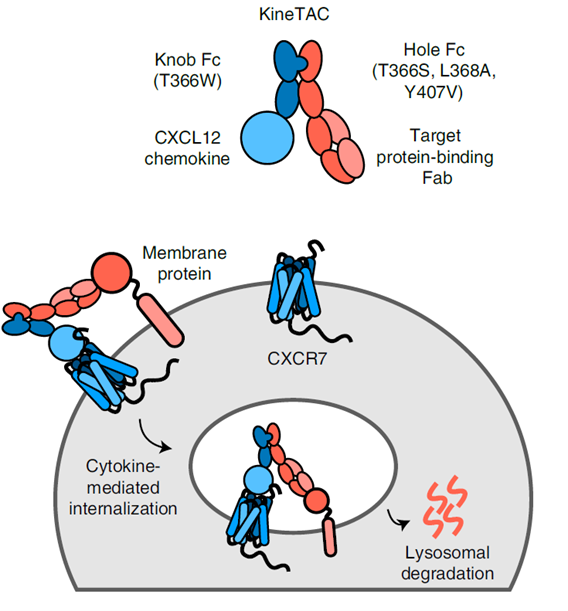
图6:KineTACs设计及作用机制[2]
KineTACs平台可以将不同的靶点的抗体与内吞的细胞因子组合,包括Her2,EGFR,PD-1或者PD-L1等,这些组合可以有效的降解目标蛋白分子,并且在多种肿瘤细胞上得到了验证。
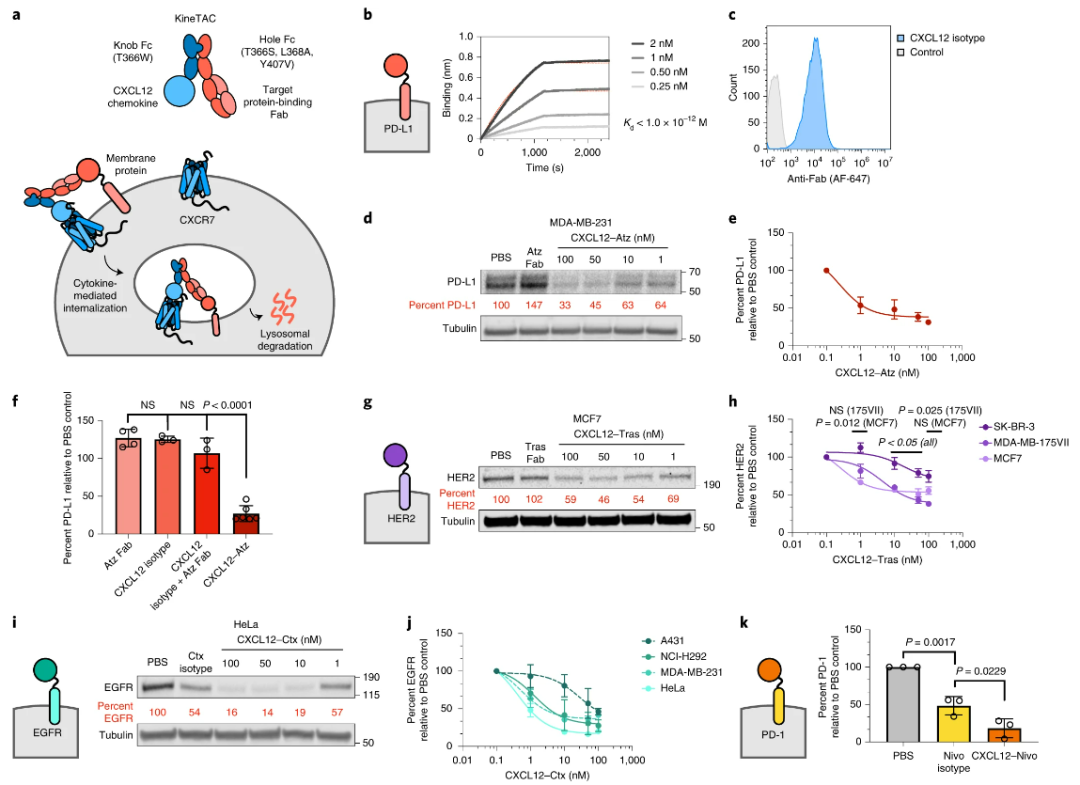 图7:KineTACs对不同蛋白的降解[2]
图7:KineTACs对不同蛋白的降解[2]
在降解效率方面,KineTACs对靶标蛋白的降解主要与抗体端对靶点的亲和力有关,亲和力越高,KineTACs的降解能力越强。从更深层次来看,其与Koff值相关,Koff越小,抗体在靶点蛋白上停留的时间越长,KineTACs的降解能力越强。除了亲和力,抗体的表位也对KineTACs的降解能力具有较大的影响,如靶向不同EGFR的抗体构建的KineTACs 的具有不同的降解能力(下图I),而其中以远离细胞膜的表位降解能力最差。
图8:KineTACs对靶标的亲和力及表位影响其降解能力[2]
在降解靶点的广度上,KineTACs不仅可以降解细胞表面的蛋白,而且还可以有效的降解游离的蛋白,如VEGF,TNF-α等,并且其降解也主要是通过细胞内的溶酶体。图9:KineTACs对游离靶标的降解[2]
以PROTAC技术为基础的药物开发逐渐分化为两个主流方向:1)以小分子为接触的传统的PROTAC的药物;2)以抗体为基础的大分子药物。其中以小分子为基础的PROTAC药物最近两年在国内外受到热捧,并且已经有多个药物进入临床中,ARV-110和ARV471为两个在临床中用于治疗转移性去势抵抗性前列腺癌(mCRPC)和局部晚期或转移性ER阳性/ HER2阴性乳腺癌的PROTAC药物,两者均由Arvinas开发。而以抗体为基础的大分子PROTAC技术最近几年层出不穷,包括LYTACs,AbTACs,GlueTAC以及刚刚发表的PROTABs和KineTACs。其中LYTACs主要是通过劫持溶酶体的降解途径,利用修饰的抗体结合靶标后将靶标蛋白带入溶酶体进行降解;而GlueTAC主要是依靠Gluebody中的非天然氨基酸(PrUAAs)和抗原中的氨基酸发生共价反应,并利用穿膜肽进入细胞溶酶体将靶标蛋白降解。AbTACs,PROTABs和KineTACs主要是通过构建双功能的抗体分子,通过同时靶向靶标分子和泛素化连接酶(或者通过细胞因子结合具有内吞的作用的受体),最终利用溶酶体对靶标蛋白降解。在药物开发中,小分子PROTAC和以抗体为基础的大分子PROTAC各有利弊且具有互补性。小分子PROTAC主要用于细胞内的靶点的降解,而且可以靶向一些不可成药的靶点,但是其筛选设计,以及成药性较差;而大分子PROTAC因为以抗体为基础因此其筛选方便且成药性较好,但是其目前主要是靶向细胞膜表面或者游离的靶标蛋白,而且以泛素化连接酶为基础的药物可能受限于细胞膜表面泛素化连接酶的影响。
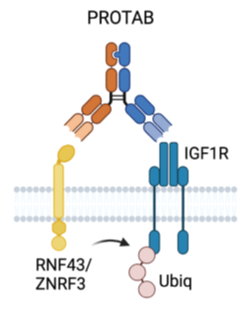

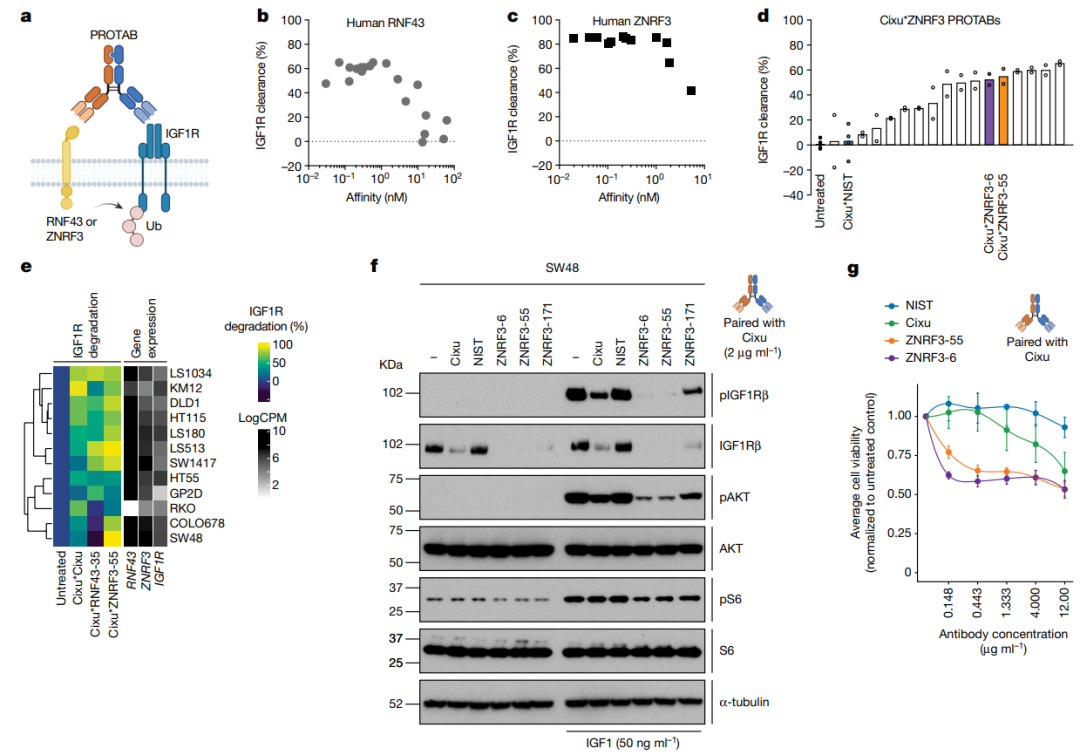

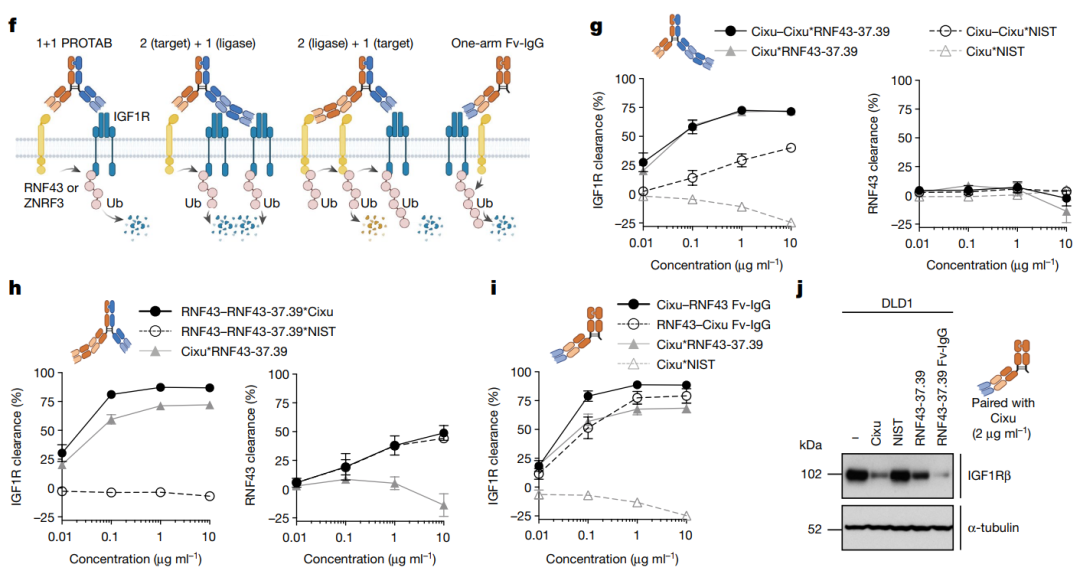

 图7:KineTACs对不同蛋白的降解[2]
图7:KineTACs对不同蛋白的降解[2]