开发针对新细胞培养的商业化灌流工艺需要一系列步骤,涉及从 μL 到实验室生物反应器的 L级规模实验,最后到数千升商业化规模。下图说明了开发新的商业化灌流培养的过程,由三个部分组成:克隆和培养基筛选、灌流细胞培养开发和工艺放大。这些部分中的每一个都有自己的目标,并且需要不同的技术。
通常,在工艺开发开始时,会有几百个克隆,来自细胞系的制备和开发,其可以与多种培养基组成结合,用于表达给定的目的蛋白。在第一步中,目标是筛选两或三个最有希望的克隆和一或两种基本培养基组成,以便进行下一步的工艺开发。作为筛选的目标参数,我们需考虑细胞特异性生产力和生长速率,暂时不考虑产品质量或培养在灌流中是否稳定。对于大量的克隆/培养基组合,必须测量这两个量。这需要非常小规模(μL-mL 范围)的高通量技术和实验。最常见的方法是使用规模缩小模型,特别是高通量设备,例如深孔板系统。这些设备通常设计用于批次或补料分批操作模式,因此不是最适合模拟灌流操作。因此,在下文中,我们考虑半连续的高通量单元。
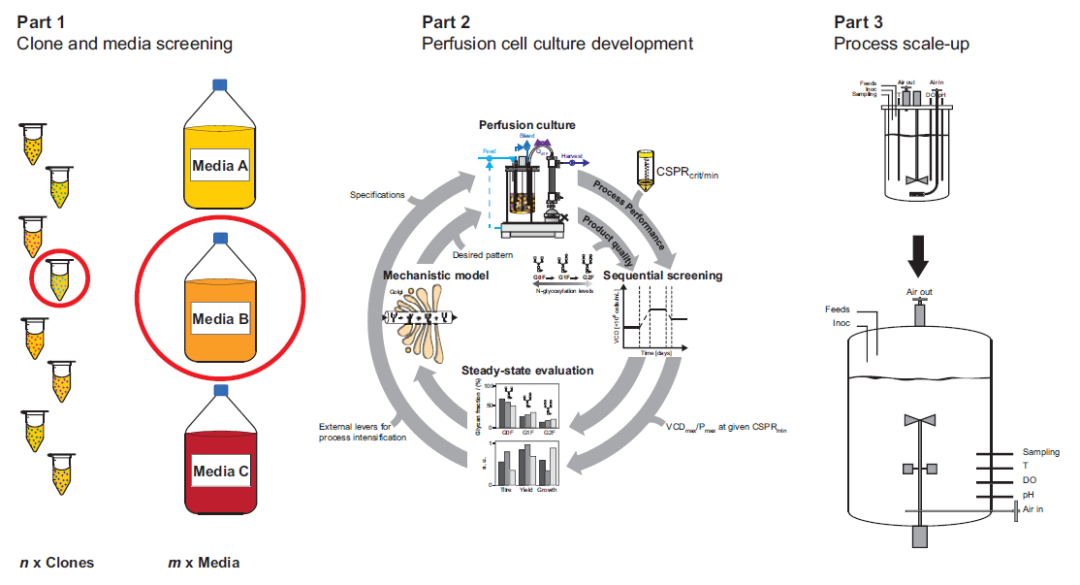
图1. 商业化灌流培养开发程序总结:第 1 部分:克隆和培养基筛选。第 2 部分:灌流细胞培养开发。第 3部分:工艺放大。
本文将主要介绍针对灌流工艺的克隆和培养基筛选。
针对灌流工艺的克隆和培养基筛选
细胞系开发从将表达载体转染到宿主细胞系开始。这包括目的外源基因的随机整合,这导致具有不同生长和蛋白质生产力特征的异质克隆库。通常,优选具有高且稳定的重组蛋白产量的克隆。然而,在转染细胞群中,只有少数克隆是高产的,因为蛋白质表达依赖于重链和轻链抗体片段基因的完全整合。由于在宿主细胞系染色体中支持高基因表达的活性区域的这种完全整合是罕见的,因此选择合适的克隆是一项关键且特别费力的任务。此外,这种高产量细胞克隆通常表现出较低的生长速率,因为大多数资源都用于蛋白质表达。因此,必须筛选大量的克隆,以便有机会找到一些具有良好细胞生长特性的高产克隆。此步骤需要高通量平台,以便同时测试和筛选大量克隆和培养基。如前所述,选择标准完全基于生长速率和生产力。
从传统上看,该步骤在补料分批和灌流应用中都以批次模式执行。通常,细胞在多孔板上按顺序稀释以筛选高产量细胞克隆,从而模拟批次操作模式。然而,最适合补料分批的克隆和培养基可能不是最适合灌流的。例如,补料分批工艺需要快速的生长速率,以便在接种过程中在短时间内积累大量细胞,以使这些高产克隆在生产阶段尽可能多地生产蛋白质。另一方面,为了在灌流生物反应器的稳态生产阶段保持恒定的活细胞密度,高生长速率会导致高废弃率,因此,导致产品产量低或产品损失高。此外,非常高的生长速率会触发高传代数,因此可能会导致长时间运行的灌流应用中的细胞不稳定。因此,对于灌流培养,稳定的细胞生长速率和高细胞特异性生产力比追求最高终末滴度和细胞密度更重要。总之,我们需要能够模拟灌流样工艺并实现长时间筛选的高通量筛选设备,以测试目标克隆的长期稳定性和高生产力。
高通量系统
为了针对灌流工艺执行细胞克隆和培养基筛选,需要满足几个要求。最关键的可能是模仿灌流操作模式。我们可以区分两种不同的方法:非稳态和稳态操作。在非稳态灌流过程中,没有废弃液流去除细胞,因此,就其特异性生长速率而言,这些细胞将在反应器中不断积累。因此,该方法中仅存在培养基添加且无细胞收获。另一方面,稳态灌流工艺需要去除细胞的废弃液流,以便在恒定的活细胞密度下运行,及时稳定。
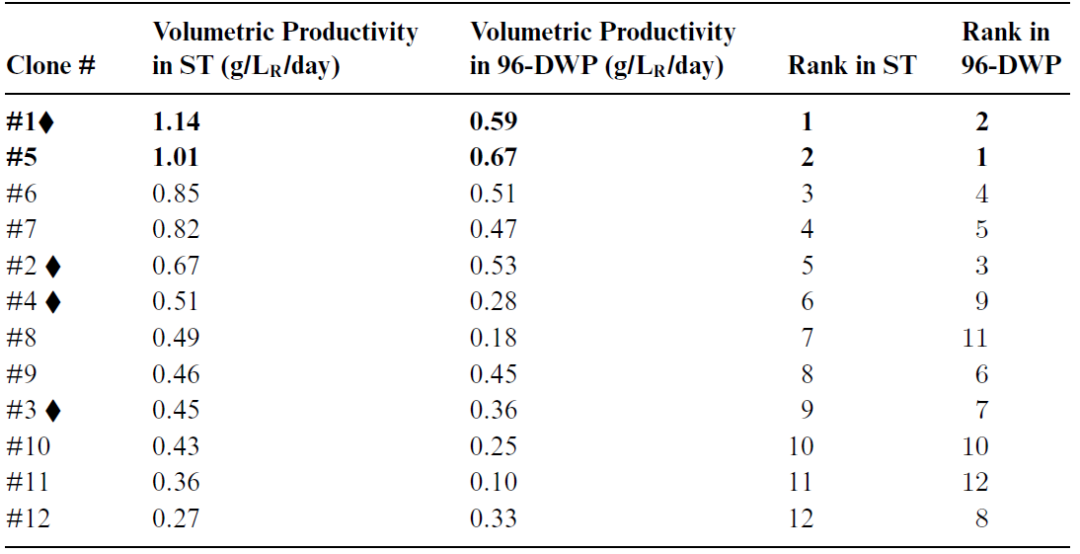
接下来我们需要一个规模缩小的高通量系统。这应该在nL、μL 规模或低mL 规模下运行,并且应该允许同时并行运行多个克隆和培养基组合。为此,需要高度自动化,以减少手动工作。该应用的潜在候选系统是使用Berkeley Lights OptoElectro 定位技术的定制纳流体芯片、深孔板(DWP)、摇管 (ST) 生物反应器以及ambr 15 生物反应器。为了说明使用这种规模缩小模型进行克隆筛选,我们在下面讨论使用深孔板和摇管生物反应器的例子,并说明在实验室规模上对获得的结果进行验证。特别是,我们考虑了一种称为VCDmax 实验的半连续程序,其允许在摇管和深孔板中以恒定的培养基置换率运行类似灌流的工艺。该程序包括每日活细胞计数、培养基和细胞的分离、去除无细胞上清液以及更换新鲜培养基,但不额外去除细胞。通过每天重复此过程,细胞密度会随时间增加,直至达到最大值 - 即在给定灌流速率下可持续的最高活细胞密度(VCDmax)。该程序已被证明适用于摇管生物反应器和深孔板的各种应用。Bielser等人(2019b) 在摇管(15 mL 工作体积)和 96-DWP(450 μL 工作体积)中验证了该程序,并将其应用于筛选一组 12 种表达相同 IgG1 抗体的不同CHO 细胞克隆,并在 VCDmax 和单位体积生产力方面对结果进行了比较。
在摇管中,应用离心步骤分离细胞和培养基,并且整个反应体积中的培养基每天更换一次。在96-DWP 中,液体处理通过机器人平台进行。此时,细胞在静态条件下静置一小时,以便在更换半个反应器体积之前将细胞从培养基中分离出来。由于难以控制吸头的高度,这可能导致额外的细胞去除,因此没有去除整个反应器体积。此外,与用于摇管系统的离心步骤相比,细胞沉降导致细胞沉淀密度较低。比较摇管和96-DWP 系统中获得的结果,特别是在 VCDmax下的单位体积生产力方面。根据在两个系统中测量的单位体积生产力对不同的克隆进行排序。在每个系统中确定了三组:高生产者(两个克隆)、中等生产者(三个克隆)和低生产者(七个克隆)。不同的克隆在两个系统中的排名并不完全相同,但至少它们属于同一组,如表1 所示。在下一步中,选择其中四个克隆,以在实验室规模(3.5 L 工作体积)的台式生物反应器中验证结果。
表1. 根据摇管和 96-DWP 中,在VCDmax 时达到的相应mAb 浓度计算的单位体积生产力值对克隆1-12 进行排名,克隆 1 和 5 以粗体突出显示,因为它们被确定为在两种筛选方法中的两个“顶级”生产者。选择用于在生物反应器中进一步研究的4个克隆以符号标识。
进行实验室规模操作的克隆筛选,以便在不同克隆之间具有足够的多样性:一个克隆是一个高生长者(高VCDmax),并且在半连续操作中给出了较高的mAb 滴度,一个克隆表现出低生长(低VCDmax)和低 mAb 滴度,而第三个克隆是高生长但低生产者,第四个是低生长但高生产者。在两个规模缩小的系统中获得的结果可以在实验室规模上进行验证,事实上,在稳态下,CSPRmin和生产力值与 VCDmax实验获得的值相似。
综上所述,该研究证明了 96-DWP 和摇管系统在筛选各种不同克隆方面的潜力。此外,这些系统的半连续操作特性能够首次预测所考虑的表达系统的最小细胞特异性灌流速率。对于两个使用的细胞克隆,规模缩小系统中预测的单位体积生产力和细胞特异性灌流速率随后通过长期实验室规模生物反应器运行进行验证。这两个规模缩小系统似乎对于在灌流模式下筛选不同的培养基和细胞系性能非常有用。VCDmax实验的设计确实允许研究人员对最小CSPR 进行初步估计,但另一方面,可能无法测试细胞的长期稳定性。在操作方便性和培养基消耗方面,DWP系统优于摇管系统,但后者优于此前介绍的纳米流芯片技术。
筛选操作的考量
事实上,克隆和培养基筛选需要非常小的工作体积,并且需要在单细胞水平上进行。此前介绍过各种规模缩小模型,它们的选择应基于所计划的实验的具体目标和工艺开发的相应阶段。
在早期阶段,涉及数百个克隆,传统的基于板的工作流程,尤其是纳米流芯片设备,提供了最具吸引力的解决方案。如前所述,在Beacon 平台中似乎可行的灌流模式筛选将有助于及早识别有希望的灌流候选克隆。这肯定是在第二阶段完成的,在将克隆数量减少到数十个克隆之后,使用96-DWP 系统和 VCDmax实验,模拟灌流操作模式。在这种情况下,评估用于此类实验的384-DWP 系统可能会很有意义。
表2. 比较各种高通量系统对细胞系和培养基筛选过程不同阶段的适用性。加号表示系统很有前途,减号表示系统不适合特定任务。

可能需要使用摇管系统或基于沉降原理的ambr 15系统进行更大规模的长期稳定性测试,甚至使用像ambr250灌流系统一样的更大规模实验。表 2 总结了不同系统对细胞系和培养基筛选不同阶段的适用性。






