核酸疫苗具备高效、灵活等
多重优势,mRNA 路径近年来快速发展
DNA技术相对成熟,mRNA疫苗在新冠开发上取得成功后蓬勃发展
核酸疫苗是将编码某种抗原蛋白的外源基因(DNA 或 RNA)直接导入动 物体细胞内(如以经肌肉注射、微弹轰击等方式),通过宿主细胞的表达系 统合成抗原蛋白,诱导宿主产生对该抗原蛋白的免疫应答,进而达到预防 和治疗疾病的目的。根据主要成分的不同,核酸疫苗可主要分为 DNA 疫苗 和 mRNA 疫苗。
DNA 疫苗由编码疫苗抗原的重组真核表达载体组成。为了将载体有效吸收 到细胞中,注射后需要进行电穿孔,被细胞吸收后,疫苗抗原从 DNA 载体 中表达出来。
mRNA 疫苗与 DNA 疫苗的工作原理相同,只是绕过了第一步(DNA 载体 的核易位和转录为 mRNA)。自我复制的 RNA 疫苗可能会使用较低剂量诱 导保护性免疫,因为每个细胞表达的疫苗抗原更多。
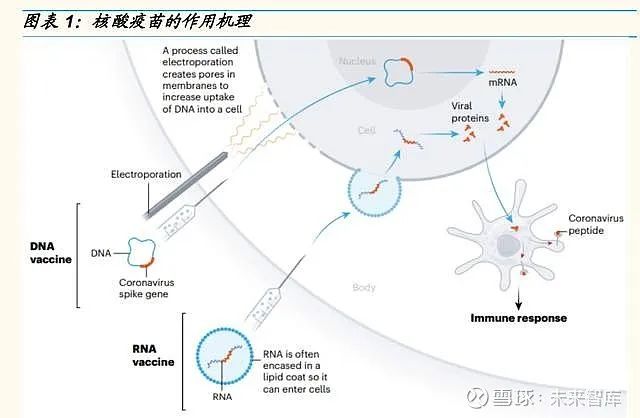
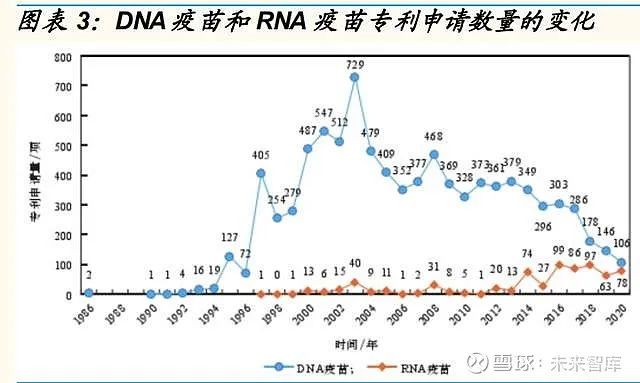
DNA 疫苗研发相对成熟,RNA 疫苗研发近年来快速发展。
从核酸疫苗的 技术研究发展趋势看,DNA 疫苗的研究论文发表与专利申请数量在 20 世 纪 90 年代末至 21 世纪初达到高峰,此后整体处于稳中有降的状态。而 RNA 疫苗则随着稳定技术和递送系统的发展步入上升期,自 2014 年起相 关论文数和专利申请量增长明显。2020 年,Pfizer 和 Moderna 的两款 mRNA 技术疫苗在应对 COVID-19 疫情上快速高效的有效性得到验证后,RNA 疫苗的研究热度明显超过其他类型。
与传统疫苗相比,mRNA 疫苗通过在实验室中改变特定病毒蛋白的 mRNA,并将其注射入人体,在人体细胞内进行病毒蛋白抗原的转化并诱导人体产 生体液免疫和细胞免疫。核酸疫苗可诱导较强的免疫反应,开发设计速度 快,可实现快速生产,生产成本低,易于在体外开展大规模生产,有利于 传染病的防控。而 mRNA 疫苗相比 DNA 疫苗也具备一些独特优势:相比 需要入核的 DNA,mRNA 不进入细胞核内部,只需要在细胞质内表达目的 蛋白;同时 mRNA 本身不具备感染性,亦能通过正常细胞途径降解,并不 存在感染或插入突变的风险。
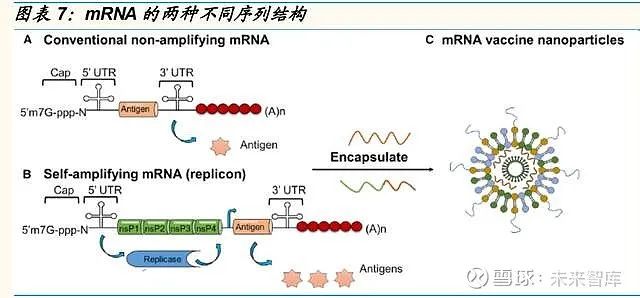
mRNA疫苗可刺激较强的免疫反应,序列设计和递送系统是关键研发壁垒
mRNA 疫苗是将外源目的基因序列通过转录、合成等工艺制备的 mRNA 通 过特定的递送系统导入机体细胞并表达目的蛋白、刺激机体产生特异性免 疫学反应,从而使机体获得免疫保护的一种核酸制剂。
目前,mRNA 疫苗主要以两种序列结构存在,传统的非复制型 mRNA 序列 和自扩增型的 mRNA 疫苗序列。自扩增型 mRNA 序列含有复制酶基因,可在细胞内扩增 mRNA,从而以较少的 mRNA 剂量生产较多的抗原。非复 制型的 mRNA 疫苗结构简单,在人体内无法自我复制,需要成熟的优化工 艺才能在较低的剂量诱发有效的免疫应答。
相比传统疫苗的技术路径,mRNA 疫苗可指导体内细胞合成蛋白质或蛋白 质片段,从而触发机体的免疫应答。mRNA 疫苗作为外源的核酸物质,表现出与病毒 mRNA 相似的特性,可在注射部位被抗原呈递细胞(APC)识 别,激活 Toll 样受体 3、TLR7 和 TLR8 等模式识别受体,促进 APC 的成熟以及炎性细胞因子和 I 型干扰素 (IFN) 的产生,然而由主要组织相容性复 合体(MHC I 类或 MHC II 类)分子呈递给 CD8+T 细胞或 CD4+T 细胞,从而激活细胞和体液免疫应答。
序列设计和递送系统是 mRNA 疫苗生产过程中最重要的环节。mRNA 疫 苗的生产流程主要可分为六步:①序列设计:根据病原体的基因组进行抗 原序列的设计和优化,并将其插入质粒 DNA 中;②体外转录:质粒 DNA 在体外通过噬菌体 RNA 聚合酶转录出 mRNA;③纯化:将 mRNA 通过高 效液相色谱(HPLC)纯化以去除污染物和其它反应物;④纳米沉淀:将 纯化的 mRNA 与脂质在微流体混合器中混合,形成脂质纳米颗粒(LNPs),快速混合使脂质瞬间包裹 mRNA,并沉淀为自组装纳米粒子;⑤筛选:透析或过滤纳米颗粒溶液,从而去除非水溶剂和任何未封装的 mRNA;⑥疫 苗制备:过滤后的 mRNA 疫苗溶液被储存在无菌小瓶中。
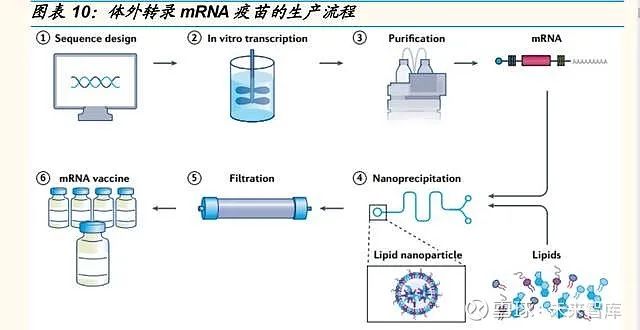
序列设计可调节优化 mRNA的表达效率,是核酸疫苗发挥作用的基础
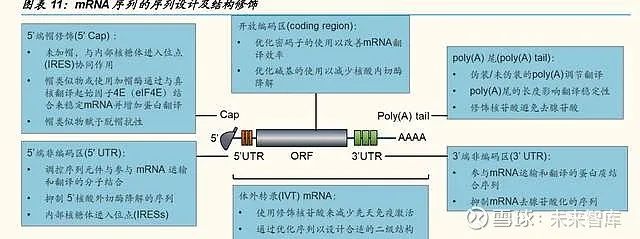
作为外源的核酸物质,mRNA 进入人体内后容易被免疫系统识别,被核酸 酶降解。为保证 mRNA 疫苗的稳定性和免疫活性,需要对 mRNA 序列进 行优化设计。传统的非复制型 mRNA 序列由五部分构成,包括 5’端帽、5’ 端非编码区、开放编码区、3’端非编码区和 poly(A)尾结构。目前主要的 mRNA 修饰技术主要包括:
①通过对 5’端帽修饰(‚加帽法‛)增强 mRNA 的稳定性和促进翻译起始,以防止 5’核酸外切酶对其降解;
②在 5'端和 3'端非编码区区域增加可调控序列,提高 mRNA 转译率和延长 mRNA 半衰期;
③修饰 3' poly(A)尾稳定 mRNA,增强蛋白质翻译,3'端非编码区的特异 性修饰可通过影响脱腺苷率而减缓 poly(A)尾的衰变。
④修饰核苷酸,减少固有免疫激活;优化序列和密码子,提高翻译率。
通过对编码目标抗原的 mRNA 序列进行修饰、序列改构或序列优化,可以 进一步优化 mRNA 疫苗的翻译效率,增加稳定性,并降低先天免疫原性。
有效的递送系统对 mRNA疫苗发挥作用至关重要
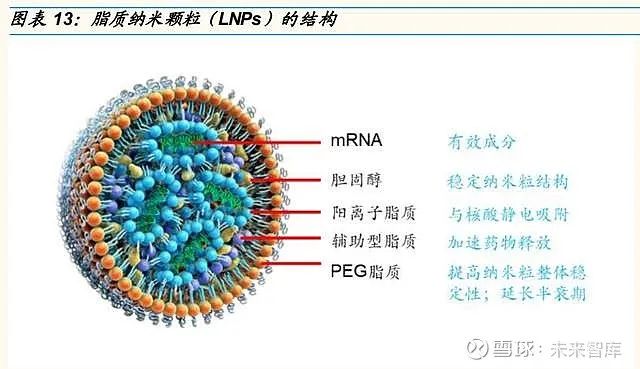
外源 mRNA 必须穿过宿主细胞膜的屏障进入细胞质以发挥作用。由于 mRNA 疫苗的不稳定性,难以通过自由扩散的方式穿过细胞膜,其引入需 要载体协助。高特异性和高效的 mRNA 递送系统是 mRNA 疫苗应用的关 键问题之一。mRNA 疫苗常用的递送系统包括:裸 mRNA、电穿孔、鱼精 蛋白、阳离子纳米乳液、修饰的树枝状纳米粒、鱼精蛋白脂质体、阳离子 聚合物、阳离子聚合物脂质体、多糖颗粒、阳离子脂质纳米颗粒、阳离子 脂质/胆固醇纳米颗粒、阳离子脂质/胆固醇/PEG 纳米颗粒。其中,脂质纳 米颗粒(Lipid nanoparticles, LNPs)是目前主流的递送系统。
脂质纳米颗粒(LNPs) 是目前最先进的递送系统,mRNA 处于 LNP 的核心 位臵,不易被核酸酶降解,且 LNP 的亲脂性使其易与宿主细胞膜融合,进 而以内吞的方式将 mRNA 传递至细胞内。典型的脂质纳米颗粒(LNPs)由四种成分组成:①可电离的阳离子脂质:通过促进自组装成病毒大小 (~100nm)的颗粒,并允许 mRNA 释放到细胞质中;②与脂质相连的聚 乙二醇(PEG):增加制剂的半衰期;③胆固醇:稳定剂;④天然磷脂:支 持脂质双层结构。在早期的研究中,LNP 的安全性已在 siRNA 的传递中得 以证明,新冠疫苗的大规模临床试验和接种应用也成功表明了 LNP 递送载 体的安全性和递呈效果。
mRNA 市场前景可观,
Big pharma 布局,Biotech 涌现
mRNA技术在疫情应对中彰显较大市场前景,疫苗是未来主导领域
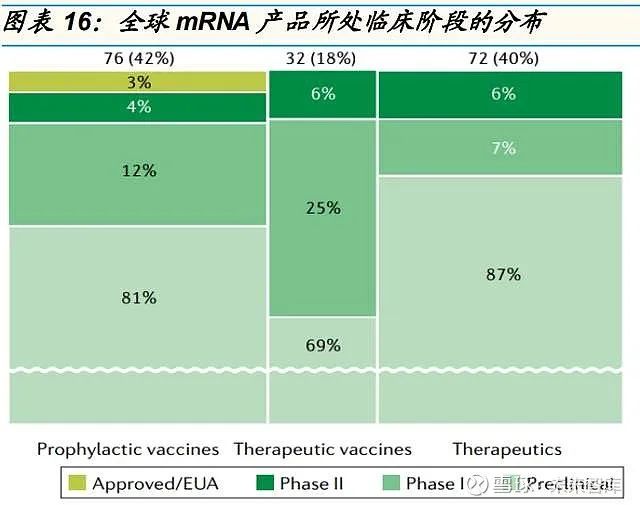
mRNA 疫苗技术在新冠疫情应对中市场前景得到较大提升。2020 年是 mRNA 技术平台的突破元年,新冠 mRNA 疫苗的推出和广泛使用极大提升 了 mRNA 疫苗的融资和市场活力。目前开发中的 mRNA 制剂有 3 个主要 应用:预防性疫苗、治疗性疫苗和治疗药物。截至 2021 年 7 月,31 家 mRNA 公司的 180 个在研产品中,76 个为预防性疫苗,32 个为治疗性疫 苗,72 个为治疗性药物。
76 个预防性疫苗中,新冠疫苗占据 22 个,其他感染性疾病疫苗 40 个,未知 14 个。
32 个治疗疫苗中,21 个为肿瘤疫苗,其中 16 个为单一癌种疫苗,5 个为 个性化肿瘤疫苗。
72 个治疗药物中,13 个为癌症治疗疫苗,20 个为治疗罕见病,17 个为治 疗呼吸系统疾病。
预计预防性疫苗将在未来 15 年内主导 mRNA 领域。由于在研管线众多,成功概率(POS)较高,mRNA 比其他疫苗模式具有优势。
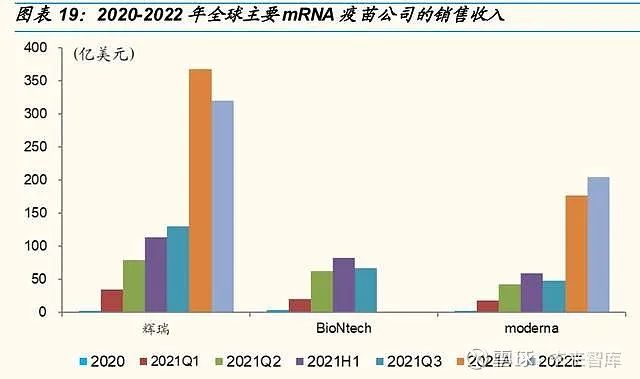
根据 Nature 预测数据,短期内,mRNA 产品市场仅基于 COVID-19 疫苗 的销售,估计 2021 年其价值将超过 500 亿美元。从目前主要 mRNA 疫苗国际巨头的 2021 年销售看,Pfizer 全年预计 368 亿美元,Moderna 全年 预计 177 亿美元。
在 2023 年至 2025 年间,预计由于主要市场对 COVID-19 疫苗的需求减 少以及缺乏新产品发布,mRNA 疫苗数量将下降。而随着其他预防性疫苗 和治疗性疫苗的进入,预计从 2028 年起 mRNA 疫苗市场将增长,到 2035 年将达到 230 亿美元。预防性疫苗仍有望成为基石,到 2035 年收入将超 过 50%。
全球龙头疫苗公司纷纷加码 mRNA平台布局,Biotech 亦获得较大资本青睐
国际四大龙头疫苗公司近年来加强 mRNA 平台布局。疫苗行业存在较高的 壁垒,全球市场格局集中度较高,赛诺菲、Pfizer、默沙东和 GSK 四大国 际龙头疫苗公司占据全球市场大部分的主要份额。近年来,海外四大龙头 公司均通过合作或收购等方式在 mRNA 技术平台领域不断加大深度布局力 度。
国内头部疫苗公司已开始投资加强新型疫苗技术和产品的布局。在新冠疫 苗的全球研发竞赛中,DNA、mRNA 等新型疫苗技术大放异彩。在新冠疫 苗极速审批和多方合作的研发模式下,国内疫苗企业迎来快速实现技术升 级的空前良机。
疫苗技术上的升级使国内企业已与国际前沿接轨,这种平 台型技术使得国内企业跨越和国际巨头在技术上的鸿沟,实现弯道追赶,促进国内疫苗行业的整体技术升级和长远发展。新冠疫苗的研发带来了新 技术、平台良好布局时点。
智飞生物投资深信生物布局 mRNA 技术。未来,公司将进一步深化与深信 生物的合作,促进 mRNA 技术助力疾病防控。
沃森生物分别与艾博生物和蓝鹊生物合作研发新冠 mRNA 疫苗、带状疱疹 mRNA 疫苗和新冠变异株 mRNA 疫苗、流感病毒 mRNA 疫苗、呼吸道合 胞病毒 mRNA 疫苗。
康泰生物与嘉晨西海达成 mRNA 人用传染病疫苗项目战略合作协议。
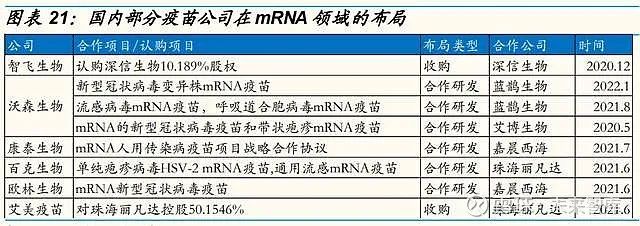
国内 mRNA 疫苗公司得到极大资本青睐,Biotech 不断涌现。目前,艾博 生物宣布完成总额超过 7 亿美元 C 轮融资,刷新了中国药企 IPO 前单笔融 资纪录。本轮融资由淡马锡、景顺发展市场基金、高瓴创投、云锋基金、礼来亚洲基金、博裕投资等知名一线机构共同领投。艾博生物自 2019 年 年初成立以来,已经完成四轮融资,融资总额超 50 亿人民币,展现了新冠 疫苗带动下资本市场对于 mRNA 技术的青睐。
新冠疫苗成为 mRNA 技术
首次获得 FDA 批准上市的应用领域
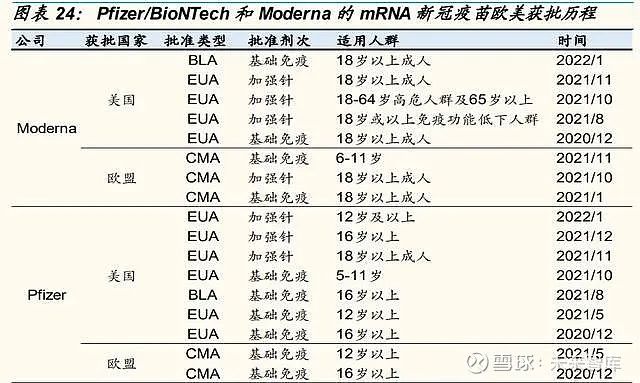
mRNA 新冠疫苗基础免疫数据良好,Pfizer 和 Moderna 相继获得 FDA 全 面批准。新冠疫情中,相比传统技术路径制备的新冠疫苗,mRNA 新冠疫 苗在基础免疫上的良好表现也体现了 mRNA 技术平台高效和灵活的优势。目前,全球已有 mRNA、重组蛋白、重组腺病毒载体、灭活等多种技术路 径的新冠疫苗获批上市、附条件上市或紧急使用授权 (EUA),其中 mRNA 新冠疫苗 基础免疫的 保 护 效 力 上 临 床 数 据 表 现 优 异。Pfizer/BioNtech 针对原始新冠毒株的 mRNA 新冠疫苗有效率达到了 95%,Moderna 的有效率为 94.5%。
21 年 8 月,Pfizer/BioNTech 的 mRNA 新冠疫苗(Comirnaty)首次获得美 国 FDA 全面批准上市,用于预防 16 岁及以上人群的 COVID-19 疾病。此 后,Moderna mRNA 新冠疫苗(SPIKEVA)的生物制剂许可申请(BLA)也于 22 年 1 月获得 FDA 批准,以预防 18 岁及以上个体的 COVID-19。
相比传统技术路径的新冠疫苗针对变异株的研发,较快的抗原设计以及灵 活的生产制备工艺赋予了 mRNA 疫苗针对变异株快速的开发速度。
针对变异株,现有技术路径的疫苗保护效力不同程度上有所下降,相对而 言,mRNA 疫苗对部分变异株仍展现出一定的保护效力。针对 Omircon 变 异株,接种两剂 Pfizer/BioNtech 的 BNT162b2 疫苗对 Omicron 变体的中 和滴度有限,接种第三剂后,针对 Omicron 的中和滴度增加了 22 倍,三 剂免疫后对 Omicron 的中和滴度水平与 Omicron 之前出现的两剂野生型和 其他变体的抗体滴度水平相似。
mRNA 在常规疫苗品种上的
应用场景广阔,当前研发多点开花
目前,全球 mRNA 疫苗技术公司在常规疫苗品种上的研发进展中,Moderna 的 RSV 疫苗 mRNA1345 的 II 期临床数据在经独立数据和安全监 测委员会审核后,进入关键的临床 III 期试验阶段。整体来看,mRNA 技术 路径在常规疫苗品种上的研发大多仍处于临床早期,未来随着管线的逐步 推进,相关里程碑节点值得期待。
传染病疫苗是目前最先进的 mRNA技术应用
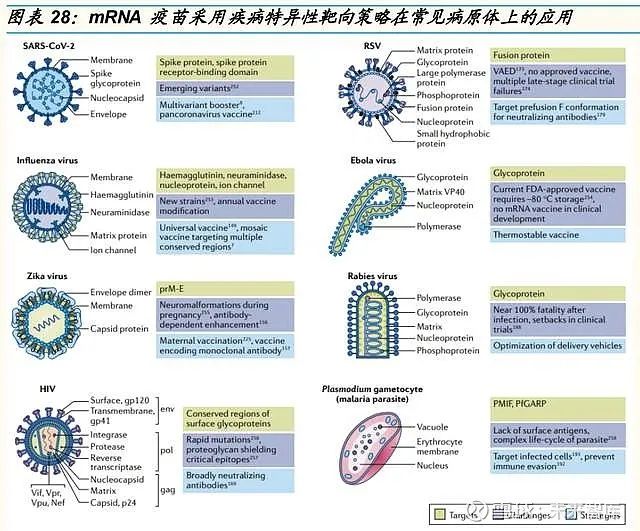
传染病疫苗是目前最先进的 mRNA 技术应用。mRNA 疫苗通常使用能够 进入细胞的表面蛋白来靶向病毒,例如新冠病毒(SARS-CoV-2)的刺突 蛋白,流感病毒的血凝素蛋白,寨卡病毒的膜和包膜蛋白(prM-E),呼吸 道合胞病毒(RSV)的融合蛋白和人类免疫缺陷病毒(HIV),埃博拉病毒 和狂犬病病毒的表面糖蛋白。每种病原体都具有各自独特的挑战,包括高 致死性,快速突变,免疫逃逸,毒株变异等。编码构象特异性蛋白、抗原 保守区域或单克隆抗体的 mRNA 疫苗可以安全地输送给健康的成年人、儿 童、老年人和孕妇。
mRNA流感疫苗:抗原漂移下 mRNA平台响应快速,I 期临床结果良好
流感疫苗是首个用于疾病预防的 mRNA 疫苗。相比传统技术路径,mRNA 技术路径在传统流感疫苗上可能具备两大优势:一是疫苗有效性的提高,二是制备速度的提高,在抗原漂移的情况下 mRNA 技术平台具备更快速的 响应能力。由于流感病毒的血凝素和神经氨酸酶极易发生变异,而且缺乏 可以有效对抗此种突变病原体的广谱性疫苗,需要每年审查和修改流感疫 苗的血凝素抗原成分。常规流感疫苗利用在鸡蛋中生长的灭活流感病毒制 备,具有生产时间较长,纯化较困难等问题,在体外转录的合成 mRNA 可 以满足替代抗原靶标的需求,并确保在出现全新的流感毒株时快速生产疫 苗。目前,Moderna 的季节性流感疫苗 mRNA-1010 临床研发进展较快。
传统流感疫苗保护效力仍有进一步提升空间。从 2004 年到 2020 年,有 5 年发生了较为显著的流感疫苗与流行毒株的错配(60%或以下)。在匹配良 好的年份(≥90% 匹配),疫苗接种者的有效性范围为 38–60%。
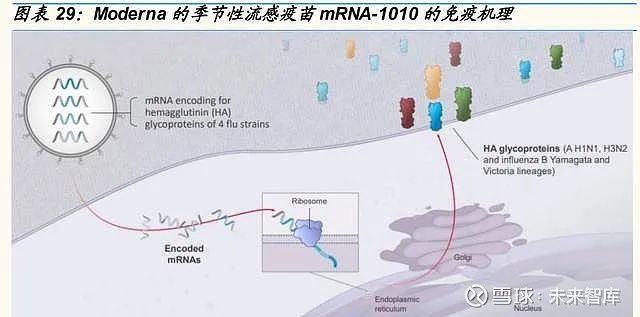
mRNA-1010 1 期结果表明,测试的最低剂量 (50 μg) 实现了高 GMT,并 达到免疫原性终点。可能显示出与当前增强型流感疫苗相似的免疫原性。
Fluzone High-Dose 疫苗是美国唯一获得许可的高剂量四价流感疫苗,由 赛诺菲巴斯德制造,批准用于 65 岁及以上人群,在老年人市场中占据主 导地位。Moderna 的 mRNA 疫苗在低剂量下仍表现出相似强度的免疫原性。
目前,Moderna 的 mRNA 流感疫苗临床 II期试验已完成入组,中期数据分 析预计于 2022 年早期获得。
Moderna 希望为当前市场带来一种泛呼吸道的年度加强型流感疫苗,mRNA 技术路径的流感疫苗有望成为针对复杂病毒的 FIC 疫苗。
带状疱疹 mRNA疫苗:Pfizer 和 BioNTech 合作开发首款
2022 年 1 月,Pfizer 和 BioNTech 宣布签署新的全球合作协议,开发首款 基于 mRNA 的带状疱疹疫苗。这是 Pfizer 和 BioNTech 在传染病领域的第 三次合作,此前 2018 年启动了流感疫苗合作,2020 年启动了 COVID-19疫苗合作。根据协议条款,两家公司将利用 Pfizer 的专有抗原技术和 BioNTech 的专有 mRNA 平台技术,分担开发成本。临床试验计划于 2022 年下半年开始。根据协议条款,Pfizer 将向 BioNTech 支付 2.25 亿美元的 预付款,包括 7500 万美元的现金支付和 1.5 亿美元的股权投资。BioNTech 有资格获得高达 2 亿美元的未来监管和销售里程碑付款。BioNTech 将向 Pfizer 公司支付 2500 万美元,用于其专有抗原技术。
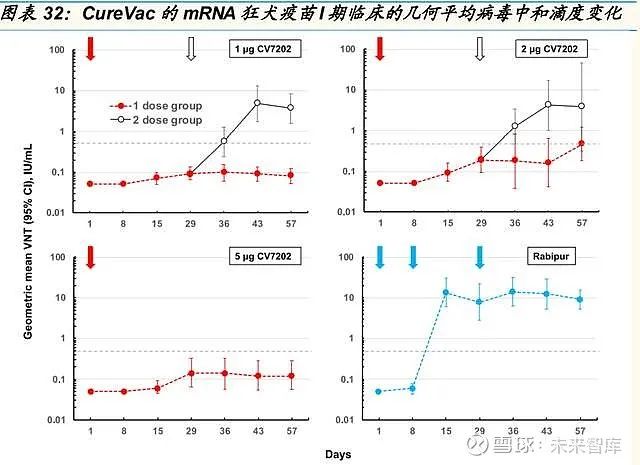
狂犬 mRNA疫苗:CureVac I 期临床试验取得积极进展
狂犬病具备较高的致死性,其特征在于神经系统症状,导致近 100%的死 亡率。目前主流的狂犬疫苗包括 Vero 细胞和人二倍体细胞等技术路径,基 于 mRNA 的狂犬疫苗可进一步提高有效性和可及性。
CureVac 部署了 RNActive 平台,使用 Acuitas Therapeutics 制造的专有 LNP 作为其狂犬病候选药物 CV7202 的递送工具,在临床前研究中,CV7202 提供了编码狂犬病病毒糖蛋白的未修饰的 mRNA,并产生了强抗 体以及 CD8 和 CD4 T 细胞反应。I 期临床试验结果表明,两剂 1μg 或 2 μg CV7202 疫苗耐受性良好,所有接种者均能引起符合世卫组织标准的 狂犬病中和抗体反应。
RSV 疫苗:mRNA技术路径 I/II 期进展良好,Moderna 启动 III 期临床
呼吸道合胞病毒是全球急性下呼吸道感染的主要原因。据估计,每年有 60 000 名 5 岁以下儿童死亡和 65 岁以上人群的 14000 多人死亡,目前尚未 有产生批准的 RSV 疫苗。1968 年,福尔马林灭活的 RSV 候选疫苗在儿童 中引起疫苗相关增强性疾病(VAED),引发了肺部嗜酸性粒细胞和嗜中性 粒细胞的过度浸润,导致 80%接种疫苗的儿童出现严重的毛细支气管炎或 肺炎,两人死亡。
目前的 RSV 候选疫苗专注于靶向高度保守的 F 蛋白,这有助于病毒融合。mRNA 疫苗可以通过设计编码序列来编码稳定的 F 蛋白构象。在临床前研 究中,使用阳离子纳米乳液成功递送编码天然 RSV F 蛋白或稳定预融合构象的 mRNA 疫苗和 LNP 没有任何观察到的 VAED 实例。
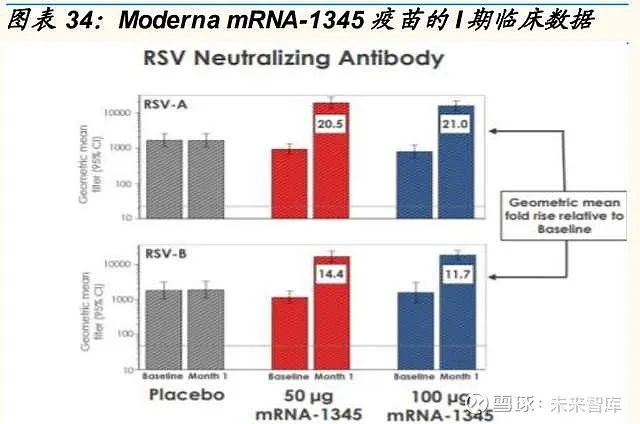
Moderna 正在评估三种编码预融合 F 蛋白的单剂量候选疫苗,包括 mRNA-1172(默克公司专有的 LNP)、mRNA-1777(Moderna 的专有 LNP),以及 mRNA-1345(Moderna 的专有 LNP)。在 I 期临床试验中,mRNA-1777 通过 RSV 中和抗体引起强烈的体液反应,且没有严重的不良 事件。在 mRNA-1777 的基础上,mRNA-1345 的序列经过进一步的工程 设计和密码子优化,以增强相对于 mRNA-1777 的翻译和免疫原性。中期 I 期数据表明,接种疫苗 1 个月后,100μg 剂量的 mRNA-1345 产生的中和 抗体滴度比 mRNA-1777 高约 8 倍。
2022 年 2 月 22 日,Moderna 公布 mRNA1345 的 II 期临床数据在经独立 数据和安全监测委员会审核后,进入关键的临床 III 期试验阶段,将在多个 国家招募约 34,000 名受试者,确定该疫苗在 60 岁以上成年人中的安全性 和有效性。
HIV mRNA疫苗:Moderna 和 IAVI 开始 I 期临床
艾滋病毒目前影响全球 3800 万人,预计到 2030 年将影响多达 4200 万人。2020 年,全球有 150 万例新感染和 68 万例死亡。尽管进行了 30 年的研 究,但目前仍未开发出有效的艾滋病疫苗,主要源于 HIV 病毒包膜蛋白具 有显著的抗原多样性和隐藏关键包膜蛋白表位的致密的‘聚糖盾’,目前一 些临床前研究已经使用了具有多种递送载体的编码 HIV 蛋白的 mRNA 疫苗。
2022 年 1 月,Moderna 和 IAVI(国际艾滋病疫苗行动组织)宣布已开始 mRNA 艾滋病疫苗的 I期临床试验,对 56 名 HIV 阴性健康成年人进行安全 性和免疫原性测试,目标是刺激特定 B 淋巴细胞产生广泛中和抗体 (bnAbs),以对抗多种流行的 HIV 变体。该试验中测试的疫苗抗原由 IAVI 和 Scripps Research 的科学团队开发,通过 Moderna 的 mRNA 技术提供,56 名临床试验的参与者中,48 人将接受一剂或两剂 eOD-GT8 60mer mRNA 疫苗(mRNA-1644),其中 32 名接受增强 Core-g28v2 60mer mRNA 疫苗(mRNA-1644v2-Core)。另外 8 名参与者只单独接受增强抗 原。参与者将在最后一次接种疫苗后接受 6 个月的安全监测,评估免疫反 应和靶向反应的实现情况。该疫苗抗原在 2021 年进行了非 mRNA 技术的 I 期临床试验,在 97%的受体中诱导了所需的 B 细胞反应,基于 Moderna 的 mRNA 疫苗技术平台,IAVI 和 Scripps 研究所的艾滋病疫苗研发进度有 望加快。此外,BioNTech 也有 mRNA 艾滋病疫苗的布局。
mRNA技术应用于治疗性疫苗,加速新的个性化肿瘤疫苗开发
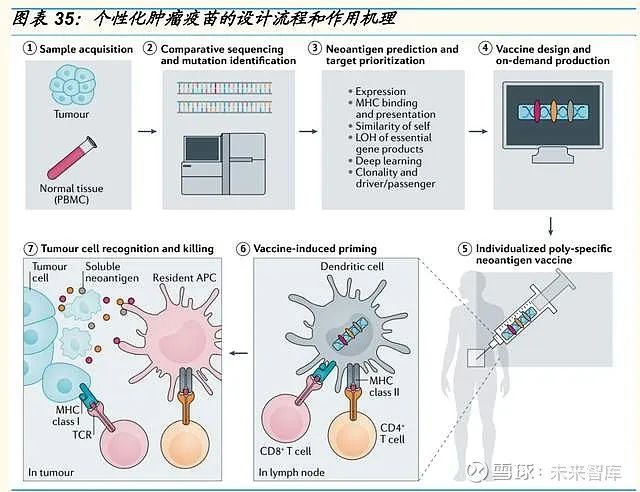
癌细胞由于基因突变可以产生肿瘤特异性表达的新抗原(neoantigens),这些新抗原可被人体的 T 细胞识别,并且不受中枢免疫耐受性的影响,也 不健康组织中表达,是治疗性癌症疫苗有吸引力的靶点之一。由于绝大多 数癌症突变是个体患者所独有的,个性化肿瘤疫苗旨在为每位患者设计量 身定制的疫苗。
个体化癌症疫苗的制造首先需要从患者体内获取肿瘤组织并且对癌细胞的 基因组进行测序,识别肿瘤特异性突变的基因组序列,然后预测新抗原的 产生和癌症疫苗的抗原设计。突变序列因有可能通过计算方法引发 T 细胞 反应被优先考虑作为候选疫苗。新抗原疫苗接种通过诱导肿瘤杀伤的 T 细 胞反应和重新激活已有的新抗原特异性 T 细胞,支持抗肿瘤免疫来恢复癌 症免疫周期。
来源:雪球






