来源:医药时间
报告出品方/作者:长江证券,伍云飞、郭心驰
从全球创新药研发和CRO行业发展周期来看:
1991-2000 年初是第一轮繁荣周期,TOP CRO 登上历史舞台;
2008-2013 年,受全球金融危机的影响,创新药研发处于萧条周期;
2014 年伊始,在生物科技突破(肿瘤免疫疗法+细胞基因治疗)和资金面宽松共同 推动下,全球 CRO 行业迎来了第二轮繁荣周期。
回观国内市场,2015 年以来的药政改革各项措施开启了国内创新药研发的闸门。很显然,外在周期和国内改革的时间点几乎是重叠的,二者共振促成了国内 CRO 行业历史性发展机遇。
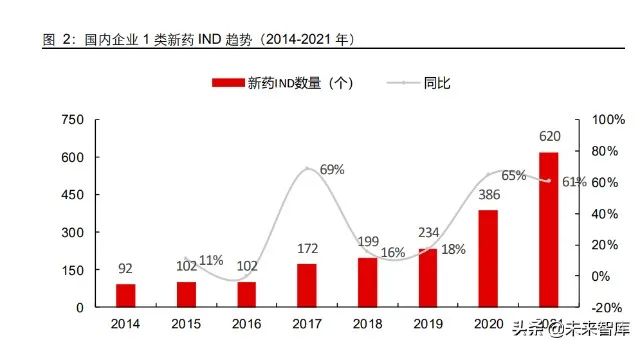
历史数据验证了 2016 年后的蓬勃发展。最近 5 年,国内 1 类新药(生物药+化药)的 IND(Investigational New Drug,新药临床申请)数量年均新增在 104 个左右。另外,每年新登记临床数量也从2017 年的 1444 个爬升到 2021 年的 2789 个。
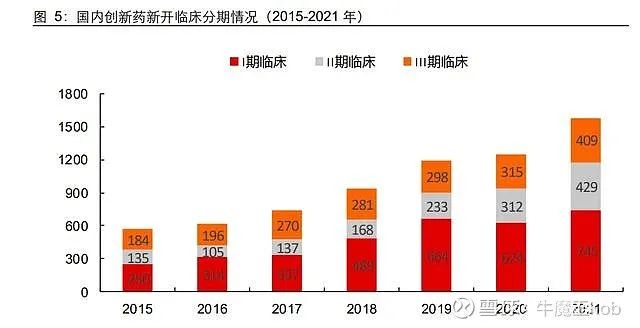
我们注意到,2018 年“4+7 带量采购试点”过后,国内企业一致性评价申报回落至稳定 水平(从 2018 年 1253 个下降至 2020 年 1024 个),并在 2021 年重拾增长。但是,标志着创新药开发的临床 1-3 期数量仍然处于平稳增加上行阶段,2017-2021年合计数量(较前一年新增数量)分别为:744(+129)/938(+194)/1195(+257)/1251(+56)/1583(+332)个。
新开临床受疫情扰动,IND 逆势加速。从 2020-2021 年的边际变化来看,IND 数量连续两年呈现出同比60%以上的快速增长,远远高于过去 3 年均值,反映出国内药企在大环境下加速突围的决心。
相比之下,临床试验由于业务属性原因受到疫情影响较大,过去 3 年不断加速的趋势在 2020 年出现暂停,但积累的临床需求在去年集中释放(1-3 期新开临床净增 332 个,同比超 25%)。
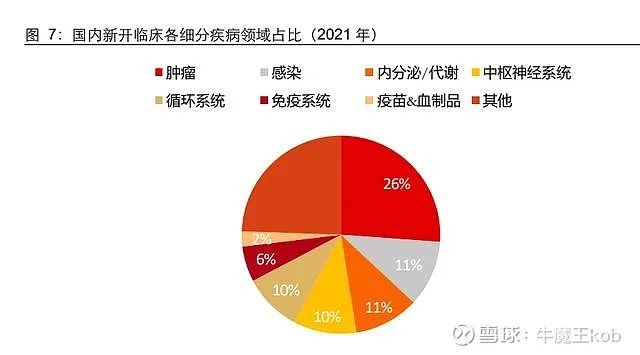
从全球范围来看,肿瘤免疫疗法(尤其是 PD-1 单抗)的出现极大地推动了肿瘤药的研发。中国境内也出现了相应的变化:2015-2021 年,国内新登记的肿瘤临床(1-4 期)从 87 个迅速增加到 828 个。肿瘤临床持续扩容,其余各主要领域均呈现“疫情下降”。从 2021 年整体分布来看,肿瘤临床占比迅速提升,内分泌/代谢、抗感染(传染病)、CNS(中枢神经系统)等主要领域新开临床占比均有下滑。而从绝对数量来看,循环系统保持不变,抗感染连续 2 年降低。
与全球市场对比,国内多个细分领域有待发展,临床需求远远未被满足。首先,肿瘤是国内外最受重视的临床领域。结合 2021 年的数据,我们发现国内肿瘤临床占比显著高 于国外(26%vs21%),肿瘤热明显;其次,国内各细分领域发展并不均衡,呼吸、皮肤和骨骼肌肉等多个领域临床数量明显偏少,随着疾病谱的演化和诊疗水平的提高,这些空白领域的临床需求将会被挖掘。
综合来看,国内创新药研发大周期虽然起步较晚,但是与全球行业复苏共振,整体发展 势头迅猛:从 IND 和新登记临床 2 个核心指标来判断,依然是加速成长阶段;同时,国 内创新药研发有“偏科”现象,当前存在的多个冷门细分领域是行业未来值得挖掘的潜力点。
重度依赖外包的 Biotech 已占据创新药研发大半江山
回望过往,2015 年药政改革为创新药研发创造了友好的环境,而 2018 年国家医保局成立后迅速推进的带量采购则给仿制药敲响了警钟,创新成为生存通道。
从现有数据来看,国内传统药企超八成放弃了转型的挣扎,而 Biotech 如雨后春笋般占据了创新药研发的大半江山。
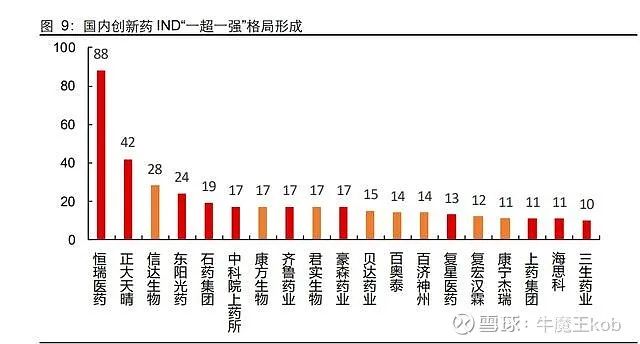
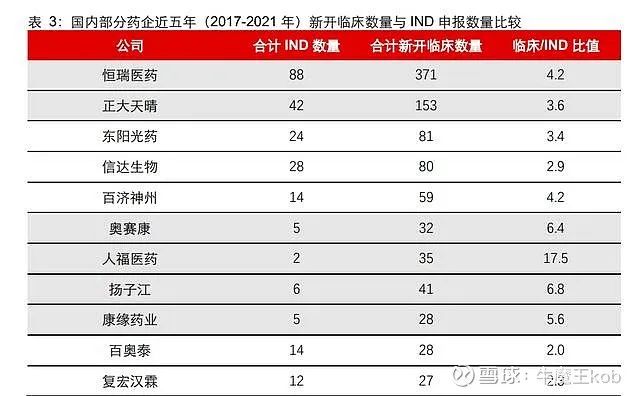
2017-2021 年,国内 1 类新药 IND 合计数量前 20 研发主体中,除去科研院所(中科院上药所),Biotech 占据了 8 席。除去独占鳌头的恒瑞医药,传统药企和新兴 Biotech 在数量上平分秋色。TOP3 主体申报数量变化趋势一致。
2018 年“4+7”试点后,仿制药生存空间被大幅压缩,头部药企申报量都是在逐年递增(TOP3),另外齐鲁药业等传统大药企也同样在不断加码。
如果从更大范围来看(5 年申报量大于 4 个),Biotech 在 77 个研发主体中占比超过 55% (共 43 个)。在前 103 申报主体中,Biotech 共占据 63 席(占比 61%),已经是创新的最主要力量。
很显然,当自主研发配套并不完善的 Biotech 成为行业创新最重要源头的时候,外包渗透率必然会有显著的提升。同时,随着国内医药产业发展趋于成熟,即使像恒瑞医药这种传统大药企也会越来越依赖于 CRO。
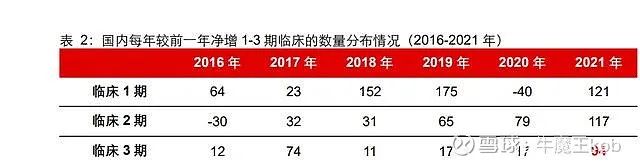
如前文所述,国内 1-3 期临床试验数量受到“722”影响从 2017 年开始加速增长。最近 5 年,新增数量分别为 129 个、194 个、257 个、56 个和 332 个。其中,有三个现象值得关注:
1)2017 年后创新药 IND 开始飙升,对应 2018-2019 年新登记 1 期临床数量快速增长。但很明显的是:临床 2 期从 2019 年才开始有较大起色,临床 3 期甚至还没有出现相应的变化。
2)新冠疫情并未遏制 2 期新开临床锐势。2020 年,创新药 1 期新开临床出现明显下 降,3 期临床持平(17 个),形成鲜明对比的是,2 期新开临床增量仍高于前一年(2018-2020 年分别新增 31/65/79 个)。
3)2021 年,新开 3 期临床出现激增。2019-2020 年,新开 3 期临床在疫情干扰下无太 大波动。但是,我们观察到 2021 年净增的新开 3 期临床接近 100 个,远远高于过去历年数据。
我们认为,随着 2017-2021 年大量新增的 IND 批件临床试验的正常推进(一般来说,临床 1-3 期试验用时分别为 1/2/3 年),考虑 2020 年新冠扰动,2021 年只是临床高峰期的初现,波峰还在路上。
从申报主体来分析,Biotech 在 IND 上的实力逐步传导至下游,在临床阶段开始崭露头角。
2017-2019 年,合计新开临床 TOP15 的药企中只包含了 2 个 Biotech,而从 2017-2021 年的统计数据来看,前 15 至少有 4 个 Biotech。从更大范围来看,Biotech 在临床阶段影响力得到凸显。2017-2021 年,新登记临床试验数量大于15个的药企共52个,除去疫苗、血制品和科研院所,传统药企和新兴Biotech 占比趋于接近(28 个 vs 20 个)。
此外,通过对新开临床和 IND 申报做数量比值分析(可反映出企业推进临床的策略和意 愿),我们发现国内创新药研发大体可分为 4 类企业:
1)申报量和临床都遥遥领先的 TOP2 龙头,仅有 2 家企业(恒瑞医药&正大天晴);
2)积极申报创新药 IND,同时迅速推进临床开展,整体较为均衡;
3)围绕仿创产品开设临床。多以传统企业为主(临床/IND 比值高),最典型的是扬子江 药业等;
4)IND 量尚可,但新开临床相对谨慎。这部分企业多以 Biotech 为主,创新能力较强,但资金受限,也有少数传统药企。
一般来说,CRO 产业链大体可分为三段:
1)从 0 到 PCC(Preclinical Compound,临床前候选化合物)的探索发现;
2)从 PCC-IND 的验证过程;
3)IND-NDA(New Drug Application,新药上市申请)的人体临床试验阶段。
由于第一段和第二段同属于 IND 前的实验室研究,所以我们也可以将整个产业链以 IND 作为界点区分为临床前(前端)和临床(后端)。从目前来看,国内 CRO 行业前端服务能力已经跻身全球一流水平,但是后端临床服务仍需假以时日。具体来看:
1)中国临床前 CRO 已经登上世界舞台
过去 20 年,以药明康德和康龙化成为代表的中国临床前 CRO 充分利用国内高学历化工人才的数量和成本优势,逐步在 0-PCC 这个阶段站稳脚跟,成功让境外订单大规模往国内转移。
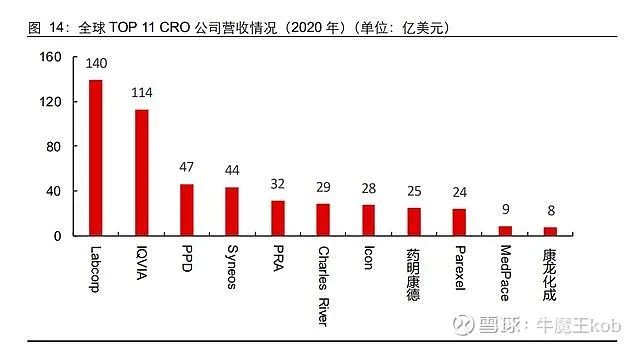
从 2020 年营收来看,药明康德位列第 8,康龙化成排在 10-15 名,二者已经是全球规模最大的临床前化学服务供应商。
另外,过去 2 年的新冠疫情客观加速了 PCC-IND 阶段的海外订单离岸,使得国内临床 前 CRO 企业再次获得了产业链延伸带来的渗透率的提升,临床前竞争地位愈加稳固。
2)国内临床 CRO 发展时间尚短,长路漫漫
全球 TOP10 CRO 中仅有药明康德和 Charles River 主业属于临床前,其余全是临床服务巨头。
由于国内创新药临床需求从 2017 年才开始快速增加,相较欧美近 40 余年的创新药开发历史不可同日而语,所以本土临床 CRO 并没有合适的成长机遇和环境,最终的结果是与 IQVIA 等全球 TOP 临床 CRO 差距巨大。
从我们统计的数据来看,新政以来外资企业在华新登记临床占比在 20%左右波动,相对稳定,但是在产业链占比最高的临床 3 期中占比超过 40%,反映出国内临床需求很大程度上和外资企业直接相关。
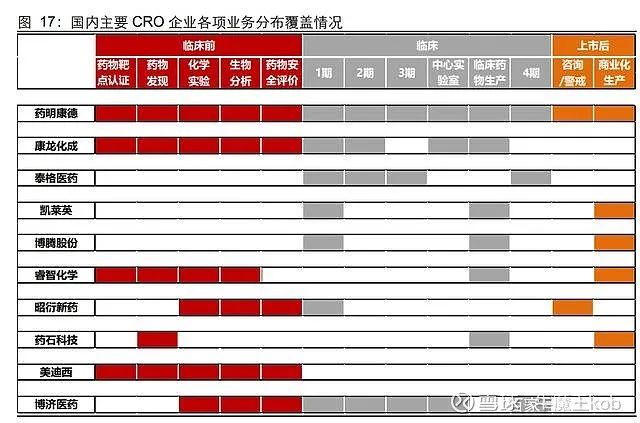
由于国内 CRO 产业链各细分领域发展并不均衡,0-PCC/PCC-IND/IND-NDA 这 3 段竞争实力从前往后依次减弱。按照业务属性、成长规模和产业链延伸情况,我们可以将国内主要 CRO 企业划分为 3 类:
1)综合型 CRO
以药明康德和康龙化成为代表,国外营收占比远高于国内、体量处于领先位置;二者都是从临床前化学服务起家,逐步拓展产业链,目前临床前一体化已经完成,正在积极推进临床服务能力建设,意图打造从前端到后端的全产业链服务能力。值得注意的是,全球范围内尚没有 CRO 能够完全实现一体化服务,国内企业已经处于领先探索阶段。
2)临床 CRO
临床服务(轻资产、偏管理属性)与临床前服务(重资产、偏技术属性)的差异较大,国内该领域目前以泰格医药为龙头,具备创新药临床综合服务能力,并积 极探索开展国际多中心临床。临床 CRO 的业务特性决定了其核心能力在于组织实施多中心临床试验,对于临床前技术服务并不擅长,所以这也决定了临床 CRO 很难向前端延伸成为综合型 CRO。
3)特色细分 CRO
由于国内 CRO 行业发展历史短,所以有不少在某些特色细分领域 形成竞争优势的企业,比如昭衍新药(安全性评价)、药石科技(分子砌块)、成都先导 (DNA 编码化合物数据库,DEL)、美迪西(临床前一体化服务)等等。
虽然国内整个创新药大周期才刚刚起步,但对于以上 3 种类型的 CRO 来说,机遇则体现在不同方面:
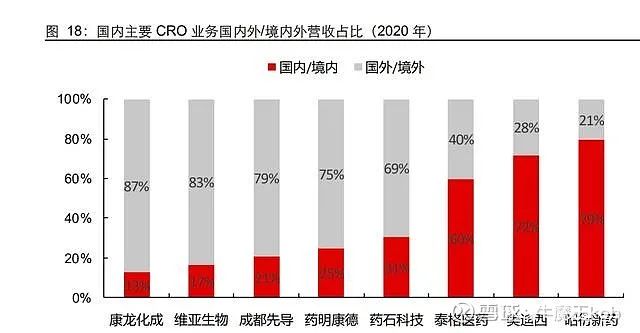
1)综合型 CRO:国内市场是增量,主要依赖于全球研发环境变化。如下图所示,药明和康龙主要营收来自于欧美全球研发中心地区,国外业务是基本盘,单国内市场对整体业绩提速贡献有限。从第三方数据来看,2019 年以来国内 IND 前的研发热度还在持续提升,所以只要国外疫情没有提前终止第二轮研发景气周期,国内综合型 CRO 内外需求都会非常旺盛。另外,如果综合型 CRO 临床业务有所进展,则会带来新的增长点。
2)临床 CRO:未来 3-5 年是国内药政改革以来第一个临床高峰。从我们前面的统计数 据来看,2017-2021 年创新药的 IND 高峰才传导到 2021 年新登记临床 3 期试验数量的激增,未来 3-5 年临床 2-3 期数量必然会快速增加,形成国内第一个临床需求高峰。但是,我们也要注意到,临床 3 期中外资企业占比较高,这部分需求很大程度上由海外 CRO 承接,对国内临床 CRO 企业而言是一个挑战。
3)特色细分 CRO:立足于优势业务,进行产业链延伸或市场拓展。具体来看,成都先导和维亚生物属于产业链起始端的药物发现平台,主要营收来自于海外市场,随着国内真正创新药研发需求的兴起,二者将会显著受益;药石科技立足于药物砌块,开始尝试 CMO 业务和自主产品研发,打造多个服务模块;昭衍新药以安评见长,境内市场占比极高,未来主要增长空间或许来自于境外市场,同时公司在尝试早期临床业务;美迪西是国内临床前一体化服务的小龙头,充分抓住了国内 IND 的红利,跟国内景气度息息相关。
综合来看,我们认为国内创新药研发仍然处于加速(维持)阶段,最受益的无疑是国内一二线 CRO 企业,不论是趋于成熟的临床前 CRO,还是在积极探索的临床 CRO,都已经处于并在未来至少 3 年内都将处于快速发展的大时代。