靶向蛋白降解(Targeted protein degradation, TPD)是药物发现领域一种极具前景的策略。蛋白质水解靶向嵌合体(PROTAC)是TPD策略最具代表性的技术,其原理是利用泛素-蛋白酶体系统(UPS)降解含有胞质结构域的靶蛋白[1](图1)。除PROTAC外,基于溶酶体的TPD策略(LYTAC)、基于抗体的PROTAC(AbTAC)和自噬靶向嵌合体(AUTOTAC)已在降解膜蛋白、细胞外蛋白和蛋白聚体方面取得成功,从而大大扩大了靶蛋白的范围。
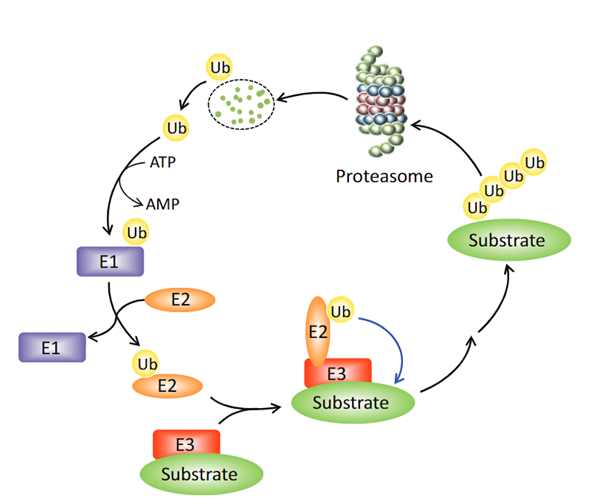
图1:泛素-蛋白酶体系统(UPS)[1]
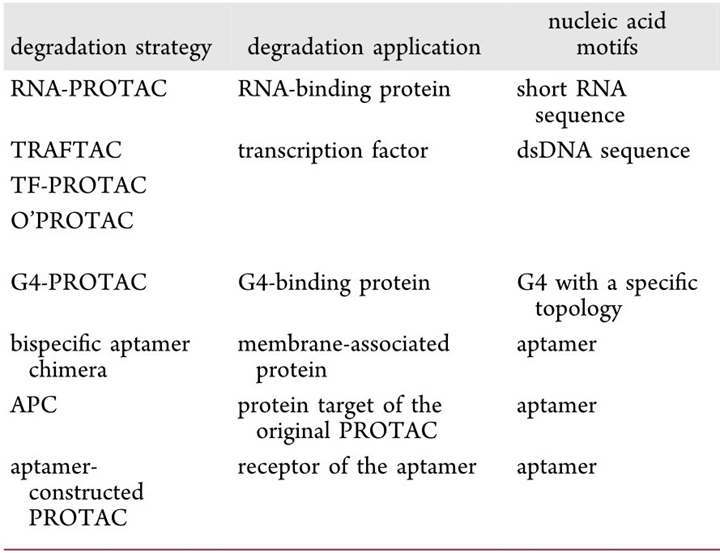
基于核酸的TPD有以下优点:一是扩大了细胞内靶蛋白的范围。利用核酸基序作为弹头的PROTAC已成功应用于降解缺乏活性配体结合位点的蛋白质,包括RNA结合蛋白(RBPs)、转录因子(TFs)和G-四联体(G4)结合蛋白。二是可用于开发膜蛋白靶向降解的平台(例如,双特异性适体嵌合体)。核酸适体还能当作靶向递送工具,用于肿瘤的特异性靶向降解。三是核酸基序可以作为靶向降解的底物治疗RNA疾病。新出现的RNA降解技术——核糖核酸酶靶向嵌合体(RIBOTAC)——表明PROTAC的嵌合降解原理已扩展到RNA领域。本篇综述介绍了基于核酸的TPD新策略,以及核酸(RNA)靶向降解的新进展[3]。
1)靶向RNA结合蛋白
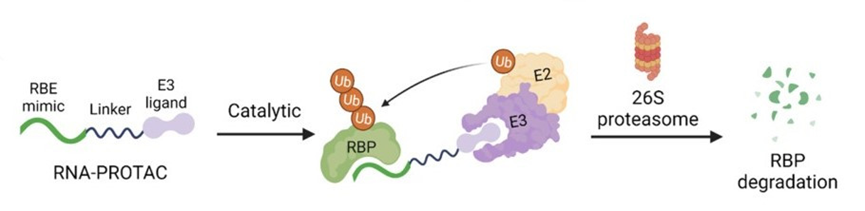

2)靶向转录因子
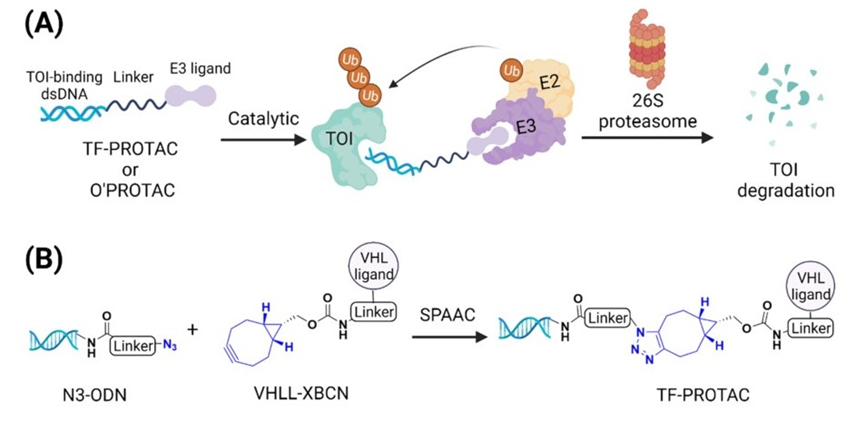
转录因子(TFs)是一种DNA结合蛋白,与特定的DNA序列相互作用,控制染色质和转录,是许多疾病,特别是癌症的重要驱动因素,近300个致癌TFs约占所有已知癌基因的20%。然而,大多数致癌TFs没有天然的配体结合袋,长期以来被认为是不可成药的靶点。虽然近期已发展出针对TFs的TPD技术,但传统的基于抑制剂的降解策略并不适用于所有TFs目标。为了解决这个问题,已经出现了多种针对TFs的基于核酸的降解剂,如下表所示(表1)。

3)靶向G4结合蛋白
G-四联体(G4s)是G-四联体是富含鸟嘌呤碱基的一种特殊四链核酸结构,通过Hoogsteen-氢键结合形成四分体的正方形平面结构,而两个或更多个鸟嘌呤四分体在阳离子(尤其是钾)配位的情况下,通过π-π堆叠形成G-四联体结构。据报道,G4s存在于许多真核细胞的基因组中,参与了很多关键的生物过程和多种人类遗传疾病,也是是近年来新发现的抗癌药物重要靶点[5]。
Phan的团队设计了第一个G4-PROTAC,使用G4作为弹头,靶向降解G4结合蛋白RHAU(图4A),该蛋白是肌萎缩侧索硬化症(ALS)的潜在治疗靶点。鉴于RHAU优先与高亲和力的全平行链G4结合,采用全平行链G4拓扑结构的序列TT(GGGT)4 (称为T95−2T)作为弹头。通过点击反应将叠氮修饰的E3连接酶招募者与5′端的T95−2T连接,组装成G4-PROTAC(图4B)。
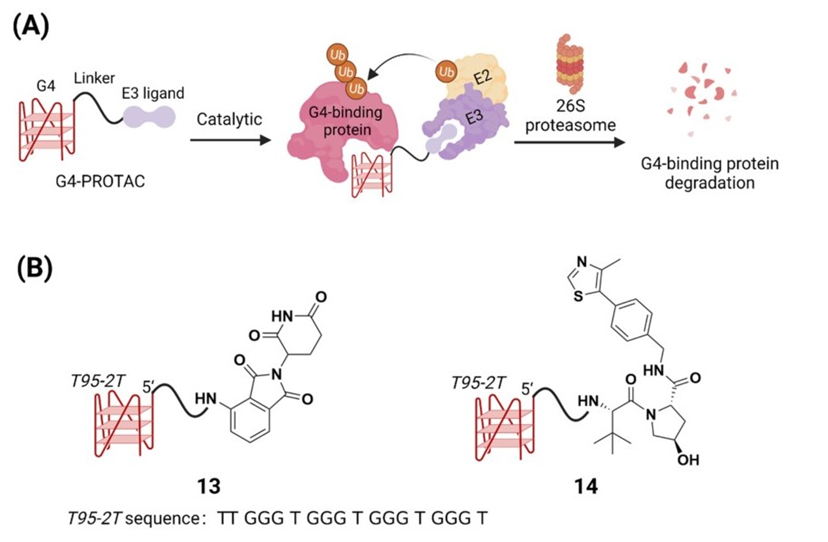
图4:G4-PROTACs的设计策略(A)和代表化学结构(B)
4)靶向膜相关蛋白
Han的团队开发了双特异性适体嵌合体,成为第一个基于适体的靶向降解膜相关蛋白的技术。双特异性适体嵌合体是一种双功能分子,具有基本结构“适体1-Linker-适体2”(A1-L-A2),其中A1和A2分别与IGFIIR和膜相关蛋白特异性结合(图5A)。广泛表达的IGFIIR是细胞表面一种典型的溶酶体靶向受体,当双特异性适体嵌合体结合时,IGFIIR与其货物一起内吞,介导膜相关蛋白转移到溶酶体进行降解。该技术已在两种膜受体——间充质上皮转化(Met)受体和酪氨酸激酶样蛋白7(PTK-7)——进行有效验证(图5B)。
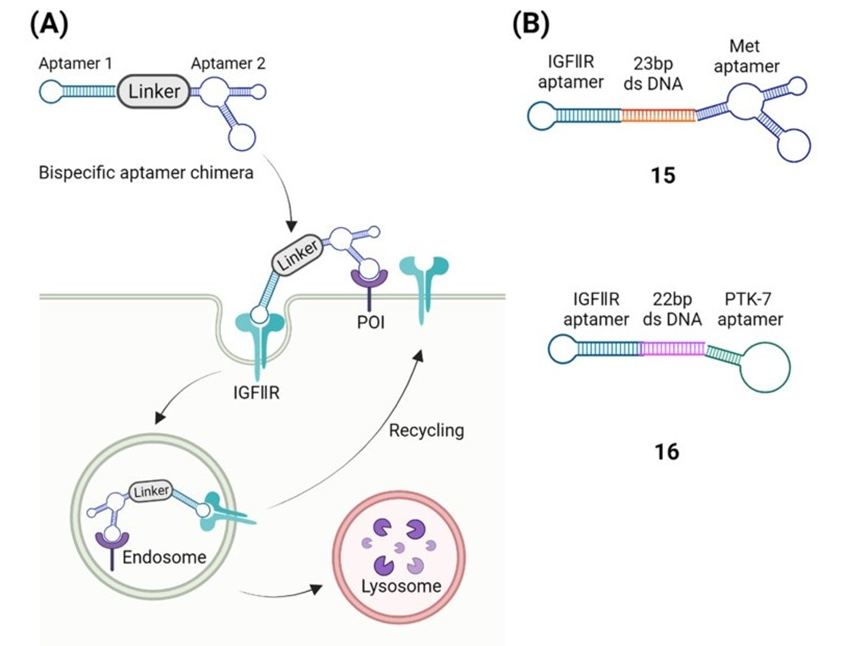
5)特异性靶向肿瘤
适体已被广泛作为肿瘤识别元件,应用于靶向癌症治疗[6]。其中,核仁适体AS1411是一种人工合成的富含26碱基鸟嘌呤的单链DNA寡核苷酸,已被深入研究并被证实具有良好的肿瘤靶向性和安全性,适合作为肿瘤靶向元件用于生化研究和药物开发。Wang的团队开发了适体-PROTAC偶联物(APCs),利用适体良好的物理化学性质和高特异性,提高了传统PROTAC的特异性和抗肿瘤效果,APC由三个元件组成:PROTAC元件(介导E3连接酶和蛋白互作,催化蛋白泛素化降解);适体元件(作为靶向肿瘤的递送载体);可切割的Linker(使原始PROTAC在细胞内靶向释放)。
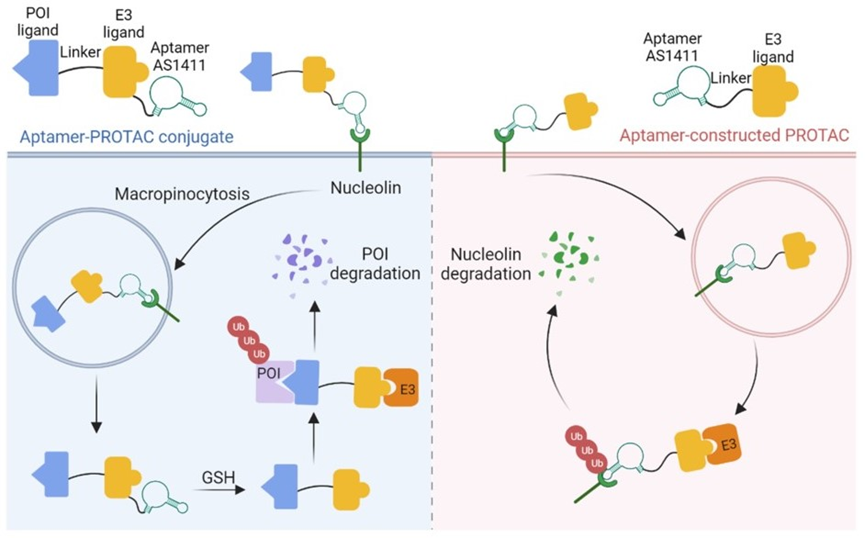
图6:适体-PROTACs的设计策略
核酸靶向降解新进展
绝大多数靶向降解技术都是针对蛋白质的。振奋人心的是,Disney的团队已经开发出几种有针对性的RNA降解方法,其中一种新的策略称为RIBOTAC[7]。RIBOTAC由一个RNA结合小分子和一个核糖核酸酶(RNase)L招募结构组成(图7)。RNase L在细胞中以不活跃单体形式普遍而微量表达,当免疫系统被激活时,潜伏的RNase L被上调并自身二聚化激活,随后裂解含有UU、UA、AU、AA和UG二聚体的胞质RNA。RNA降解导致翻译停滞,从而抑制蛋白质合成和病毒复制。总之,RIBOTAC是一种新的化学程序,通过动员局部先天免疫反应,实现对目标RNA的选择性切割和降解。与TPD相比,核酸靶向降解还处于起步阶段。
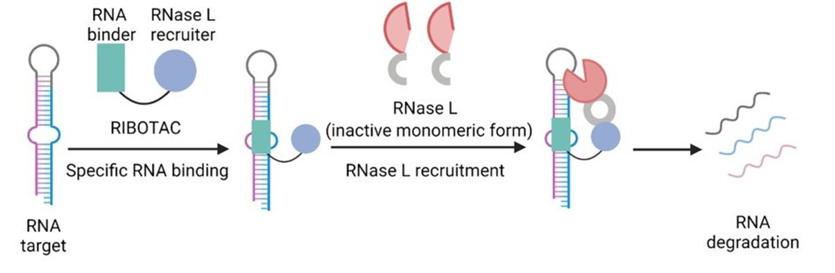
图7:RIBOTAC设计策略
结 语
目前,基于核酸的TPD策略已经引起了广泛的关注,大大扩展了靶标蛋白的范围,并且具有制备简单、合成精确、特异性高、效高率和毒性低的优势,现已经开发出几个技术平台,如下表所示(表2)。
尽管基于核酸的TPD策略进展飞速,但仍存在一些挑战。一是寡核苷酸的不稳定性可能会限制相应的嵌合体在体内的应用;二是寡核苷酸的不稳定性和负电荷导致需要其他递送方式才能进入细胞;三是寡核苷酸的快速降解可能导致不利的药代动力学缺点。总之,长路漫漫,基于核酸的嵌合降解剂应用于临床还需要更深入的探索研究。






