由于最近的成功和 AAV 的挑战,以及 mRNA 作为一种新的 COVID 疫苗方式的意外胜利,基因治疗生产正在快速发展,这进一步引起了人们对非病毒基因治疗的兴趣。我们首先介绍新的生物分子形式,这些形式可能正在取代用于疫苗和基因治疗的质粒,尤其是狗骨 DNA (doggybone DNA,dbDNA),它在 2022 年吸引了许多额外的行业兴趣(包括与拜耳、龙沙和默克的交易)。然后我们讨论生产 AAV 的新选择,对于非病毒基因疗法,我们将介绍集成式自动化生产箱的趋势,我们还将在第 2 部分中介绍用于细胞疗法的类似技术。然后我们将介绍新的纯化方法以及新的分析设备和技术。
1. 新的生物分子形式
改进的质粒
核酸是编码 CGT 中几乎所有体外或体内细胞修饰所必需的。DNA 或 mRNA 疫苗以及一系列其它潜在药物,如更便宜的长效抗体疗法(单克隆抗体、纳米抗体或鸡尾酒疗法)也由 DNA 生产。最常见的 DNA 形式是质粒。质粒由细菌产生,因此包括复制起点。基于营养缺陷型、毒素-抗毒素、操纵子-阻遏物、基于 RNA 的选择标记或必需蛋白质的过度表达的替代选择方法早已被描述。然而,大多数质粒还含有抗生素抗性基因,用于选择含有目标质粒的细菌。这些序列占用空间但不赋予任何直接有用的功能。它们还增加免疫原性。此外,复制起点的存在可能导致不受控制的质粒扩增。抗生素抗性序列也涉及一定程度的风险,因为质粒可能会水平转移到患者体内的微生物组或病原菌中。监管机构可能会推动使用不含抗生素抗性基因的质粒。例如,自 2011 年第 7 版以来,欧洲药典规定“应尽可能避免在最终 GTMP 中使用抗生素抗性基因,在无法避免的情况下,应证明其合理性”。对于 AAV 应用,Nature Technology(美国纽约州Pleasantville)开发了特殊的“Reviver”大肠杆菌菌株,可以产生反向串联重复序列(ITR)和含有大回文序列的质粒,其产量和质量均高于 Stbl2、Stbl3、Stbl4、SURE 或 NEB 等常用菌株。
除传统质粒外,Minicircle DNA 是一种环状 DNA 形式,由 Plasmid Factory(德国Bielefeld)根据 Nature Technology Corporation的许可进行推广和销售。它是没有抗生素抗性基因序列和细菌复制起点的环状载体。这些环状载体是通过位点特异性重组在体内从亲本质粒生产的,主链序列产生可以丢弃的“微型质粒”(mini plasmid)。当用作工具时,它们在 AAV 或转座子生产等各种生产步骤中比传统质粒更有效。 Aldevron 最近收购了 Nature Technology 及其第二代微型环状 DNA 形式,即“纳米质粒”(nanoplasmid)。与 Minicircle 相比,Nanoplasmid 更容易生产,具有更高的产量和更高的转基因表达。在一些实验中,纳米质粒的 AAV 转导效率比质粒高 30 倍。优势包括用于基于蔗糖的选择和真核生物中高转基因表达的小“RNA-OUT”细菌区域大小(小于 500 bp)、提高的生产产量、降低的成本和毒性。
Touchlight 的 dbDNA
一种更具创新性和更有前途的形式是无细胞合成的“doggybone”(狗骨)DNA,商标为 dbDNA。如图2所示。
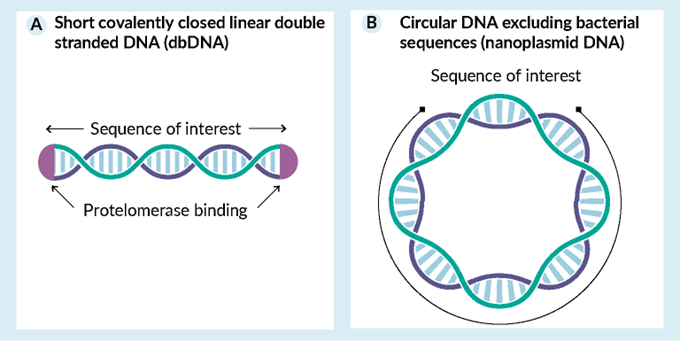
图2. 新的DNA形式:A) 极简酶合成的db-DNA和B) 细菌合成的环状纳米质粒DNA。
Doggybone DNA 是一种双链、共价闭合的线性 DNA 形式。它仅包含目的序列 - 最多 20 kb - 两侧是被称为原端粒酶的酶识别的两个短序列。Heinrich 等人最先描述了一种doggybone DNA形式。十多年来,TouchLight(英国Hampton)对其进行了改进。TouchLight 现在有能力生产公斤级的 dbDNA,并在内部广泛应用,且与 100 多家客户和合作伙伴合作。dbDNA 是在没有任何细胞的情况下纯酶促产生的,使用滚环扩增,然后进行原端粒酶反应。这种简化的“化学”过程可以将生产时间从质粒的大约三个月缩短到 dbDNA 的仅一两周。它还大大减少了洁净室的占地面积和生产、规模放大的复杂性,并在某种程度上降低了监管的复杂性。规模放大消除了对主细胞库和产量优化的需求。也没有细菌序列,没有抗生素抗性基因,也根本没有细菌污染物。dbDNA 减少了周转时间(从质粒的几个月缩短到几周)并且还可以降低商品成本,特别是对于小规模定制生产。重要的是,不稳定或难以扩增的、并可能导致质粒生产批次失败的序列,包括 AAV 反向末端重复序列 (ITR),被认为更容易掺入 dbDNA 。它已成功用于生产慢病毒 (LV) 、AAV(TouchLight 和被许可方以及之前的合资伙伴拜耳旗下的 Ask Bio 提供基于 dbDNA 的 AAV CDMO 服务)、mRNA、CAR-T(通过 piggyBac 转座子系统),此外,也正在直接作为用于水产养殖和人类的DNA疫苗进行测试。该公司表示,其在英国Hampton的设施的持续扩建应该使其能够每月生产多达 1 千克 DNA。TouchLight 最近将其 dbDNA 专利非独家授权给辉瑞,用于基于 mRNA 的疫苗、疗法和基因治疗应用,授权给 Lonza,用于 mRNA 服务,以及授权给 Voyager,用于其衣壳发现平台。它提供一个现成的结构和报告基因目录,用于快速测试 dbDNA,用于生产 mRNA、AAV、LV、基因组编辑、非病毒基因治疗和 DNA 疫苗。该公司宣布了一项关于其 DNA 结构的细胞内可视化的研究项目,这对于任何基于核酸的疗法来说都是一个有趣的话题。
其它形式
4Base Bio(英国剑桥)是较早阶段的竞争对手,它使用两种专有酶的组合,一种聚合酶和一种引物酶 - 可以重新启动停滞的复制叉 - 用于 DNA 的无引物扩增。其发夹 DNA (hpDNA) 形式是一种共价闭合的双链线性 DNA,在 5' 和 3' 末端具有单链发夹。它可用于病毒(例如 AAV 合成)和非病毒基因治疗。在现阶段,这家还提供 CDMO 服务的公司尚未以与 TouchLight 的 Doggybone 相同的规模生产其 DNA。比较这两种工艺和产品(例如速度、成本、生产 DNA 或用它生产 AAV、保真度、纯度)及其用于非病毒基因治疗时的临床表现(例如免疫原性、稳定性、剂量、组织嗜性)将是一项有趣的工作。
治疗公司 Generation Bio(美国马萨诸塞州波士顿)也在为其封闭式 DNA 平台 (ceDNA) 开发酶促合成工艺,目前正寻求将其推广到整个产品组合。另一家治疗公司 Intergalactic(美国马萨诸塞州波士顿)拥有一种称为 C3DNA 的共价闭合环状 DNA 格式,其无细胞生产过程没有细菌来源的序列。它通常是双链的,包括一个末端重复序列,例如 DD 元件。它可以通过脉冲电场装置局部注入,也可以潜在地封装在 LNP 或其它纳米载体中。
OriCiro(日本东京)开发了另一种用于大型(高达 1MB)环状 DNA 扩增的纯体外系统,并在科研规模上实现了商业化。复制循环反应 (RCR) 由 26 种纯化的蛋白质组成,这些蛋白质在等温反应中介导大肠杆菌染色体复制循环。它采用转座子介导的 OriC 插入来复制缺少 OriC 的大环状 DNA,即使没有任何序列信息。保真度非常好,每个碱基每个循环的错误率大约为 10-8 个错误。该公司正在努力扩大这一工艺,考虑到涉及的酶数量众多,这并非易事。或者,该工艺的组装步骤可以与不同的扩增方法相结合。
备注:mRNA 和环状 RNA
mRNA 是一种如此有效且可快速生产的针对 Covid-19 的疫苗,相对容易从上述任何一种 DNA 形式在体外生产。TouchLight 表明,与使用 pDNA 的标准方案相比,从 dbDNA 生产 mRNA 需要的 DNA 数量更少。mRNA 生产通常涉及添加长 poly-A 尾和加帽试剂,例如 Maravai Lifesciences(美国加州圣地亚哥)的 TriLink CleanCap。4Base Bio 开发了其它针对 mRNA 体外转录优化的双链线性 DNA 形式:部分开放的 opDNA 和开放末端的 oeDNA(也可用于通过同源定向修复进行基因编辑)。针对Covid-19 的 mRNA 生产速度和规模意味着尽管根据目标应用在形式上还有很大的创新空间,但从生产规模和成本的角度来看,生产 GMP mRNA 的问题在很大程度上得到了解决。此外,也可以从 DNA 合成各种其它 RNA 形式,包括自扩增 RNA (saRNA)、反式扩增 RNA (taRNA) 和用于 RNA 干扰 (RNAi) 的小干扰 RNA (siRNA) 或小发夹 RNA (shRNA)。
LaRonde Therapeutics(美国马萨诸塞州波士顿)和 Orna Therapeutics(美国马萨诸塞州剑桥)等公司已宣布更新的形式包括环状 RNA 形式,旨在实现低/无免疫原性、更高的稳定性和更高的表达。
pDNA 是学术界和工业界无处不在的核心形式,研究级质粒现在非常容易获得且成本低廉。然而,高质量或符合 GMP 标准的生产成本可能很高,尤其是对于小批量生产。新的核酸形式在工艺和产品层面都带来了许多材料优势。针对某些工艺和应用,可以使用新形式来替换pDNA,而支持快速检测和基准测试的现成标准可加速这种趋势。提供快速周转、小规模定制合成服务,同样会简化许多开发人员的过渡。
框 2 体积、规模和成本概述。
体积和产能需求
已安装的 CGT 产能
Bioprocess International 估计,目前的生物制药产能约为 1,700 万升,其中哺乳动物细胞约 1,200 万升,细菌约 500 万升,血液和血浆约 100 万升,植物细胞和酵母也有少量产能。CGT目前只占该规模的 1.2%,其中,约87,000 L 用于基因治疗和 约 122,000 L 用于细胞疗法。每剂细胞数量因细胞类型和细胞疗法的适应症而有很大差异;对于基于病毒载体的基因疗法,病毒剂量的变化范围更广。我们将介绍 AAV 的产能估计。
AAV 的产能需求
为局部注射而生产的 AAV,例如在眼科适应症中,只需要大约每剂 10^11 – 10^12 病毒基因组 (vg)(例如,Luxturna 的剂量是每只眼睛 1.5×10^11 vg)。对于每年有 1,000 名患者的小适应症,只需生产 10^14-10^15 vg AAV,不需要大量的产能。当 LV 用于转化细胞进行体外基因治疗时,观察到相同的情况。相比之下,为全身递送而生产的 AAV 目前每剂需要 10^15-10^16 vg,例如,对于Zolgensma,9公斤的患者需要10^15 治疗杜氏肌营养不良症 (DMD)需要4×10^15。如果目标人群较大,例如 10,000 名患者(对 DMD 的合理估计),那么需要生产相当数量的纯化 AAV,10^19–10^20 vg。最近的一份白皮书估计了为 DMD 生产 AAV 所需的产能:大约 80 个 3,000 L一次性生物反应器(每年 20 批次,约 40% 冗余),是针对这种单一适应症的已安装基因治疗产能的三倍!根据类似的假设,我们计算出大约需要五万个 40 层 CellFactory 系统,或者大约七百个 500 m2 iCELLis 固定床系统,这些都是不切实际的。重要的是,产量因血清型的不同而有很大差异,这些只是粗略估计。然而,这个例子说明了需要新技术来强化悬浮培养并提高 AAV 滴度和整体工艺产量。
临床试验物料需求
多位作者预计到 2026 年将进行约 10,000 项活跃的 CGT 临床试验,总共招募约 100,000 名患者。这意味着未来几年 CGT 生产量将急剧增加。它还带来了超越规模的新挑战:灵活性和速度。在为临床试验生产 CGT 产品时,生产成本通常是次要考虑因素,因为它主要由试验中的其它成本决定。重点是可以快速优化的灵活工艺,以减少在临床上推进候选产品以及在专利有效期间实现商业化的时间。展望未来,人们还需要能够有效且快速放大规模的工艺。考虑到试验中 CGT 候选产品的数量和多样性,最著名的 CGT 开发商和大多数 CDMO 也希望拥有一种可以根据管线的命运轻松、快速地从一个生产工艺重新分配到另一个生产工艺的能力。
COGS
补充表 2 提供了自体细胞疗法、质粒、AAV 和 LV 的 COGS 估计范围。产品的性质(例如 AAV 血清型,它对产量有很大影响)、生产模式(例如细胞疗法的集中式与分散式,质粒生产的内部与外包),当然,规模也会影响这些估计。药物成本和价格必须放在整体医疗成本的背景下考虑(见下文自体 CAR-T),而制药行业无疑是巨大且高利润的,但医药支出也不到整体医疗支出的 15%。然而,公众对某些价格的强烈抗议、来自监管机构的压力以及规模需求,同时能够为支持复杂而漫长的研发的投资者和公司提供有吸引力的投资回报,以及药物开发固有的高风险和失败率,意味着许多 CGT 模式实现工业化的目标必须是降低生产成本。
DNA
对于 GMP 质粒 DNA,小批量 GMP 质粒 DNA 的生产仍然很繁琐,COGS约为每克 20,000-50,000 美元,具体取决于序列复杂性。这部分是由于为小规模生产建立细胞系和工艺的成本。在产能不足的市场上,它们的售价约为 100,000 至 300,000 美元,该市场由 Aldevron 主导(2021 年被 Danaher 以 96 亿美元收购)。由于涉及序列,用于病毒载体的质粒 DNA (GMP 或“高质量”/“GMP 源”)的合成也非常复杂,这可能导致批次失败,并降低产量。通过放大发酵和下游工艺,更大规模的生产可以更具成本效益。一个 2,000 L 的发酵罐通常可以产生数千克的 DNA。事实上,Zydus(印度Ahmedabad)基于 pDNA 的 ZyCovD 分三剂,每剂 2 mg,售价 265 卢比(3.42 美元),COGS不会高于每克 1,000 美元。另一家 DNA 生产商 TouchLight Genetics 正在开发一种用于水产养殖的 DNA 疫苗,这表明尽管与细菌发酵相比规模经济不太明显,但其体内方法应该在规模上具有竞争力。因此,尽管目前产能紧张、价格高且交货期长,但我们发现 DNA 成本在未来不应成为大规模的大问题。成本和利润的分配将取决于治疗开发商的供应和生产链,他们可以在内部完成所有事情,包括 DNA,或者使用 CDMO,他们自己可以将质粒 DNA 等工作分包给另一层面的专业 CMO。我们也没有预见 RNA 的重大 DNA 成本问题,其通过体外转录从 DNA 产生涉及 10-30× 扩增。
AAV
对于 AAV,有研究人员使用Pall 的 iCELLis 系统或悬浮系统计算出 10^14 vg 剂量的优化总成本为 10,000-15,000 美元。对于局部给药的 AAV 适应症,该成本是可以接受的,但全身给药的适应症需要显著降低成本,因为后者将需要大约 15 倍的物料。我们预计这些降低将通过更好的上游和下游生物工艺以及改进的生物学(通过更好的组织靶向以及更高的感染性、以降低剂量需求的工程衣壳)的组合来实现。
自体CAR-T
对于自体 CAR-T,市售产品每次治疗的售价约为 50,0000 美元,据估计,COGS 约为 30,000-10,0000 美元。重要的是,在美国,对于Kymriah,输注后2个月的治疗费用高达65,000美元,与药物生产的成本相当,甚至高达两倍。这些费用包括“白细胞去除术、淋巴细胞耗竭化疗、tisagenlecleucel 输注/给药、住院和重症监护病房 (ICU) 入院、医疗专业人员就诊、实验室检测/程序以及不良事件 (AE) 的管理”。同样,除了工艺改进之外,生物学上更先进的药物可以以更小的剂量给药,副作用更小,而且可能不会导致淋巴细胞耗竭,这也有助于降低成本。值得注意的是,在中国这个最重要的潜在市场,生产和其它处理成本可能会低 2-3 倍。对于自体疗法,每个患者都需要单独生产,因此规模经济远不如放大 AAV 或质粒生产时明显,尽管并非不可能。关于细胞疗法生产的 LV 部分成本,Comisel 等人的研究表明,使用搅拌罐生物反应器 (SUB) 可以将每剂成本降低至约 2,000 美元(2,000 L SUB 生产 5,000 剂)。非病毒替代品则更便宜。






