成功的技术转移和规模放大需要坚持详细且充分的项目管理。
技术转移是产品和工艺知识在开发和生产之间以及生产站点内部或之间的转移,以实现项目的实施。制药和生物技术公司进行技术转移的关键原因是确保为患者提供充足的供应,并且有生产的后备战略,这是管理风险所必需的。此外,可能缺乏用于工艺优化、商业生产、二次包装和/或供应链管理的适当资源/能力。由于需要更大的批量(例如,从临床生产转移到商业生产),因此项目放大也需要进行技术转移,以提高生产效率。
由于其复杂性,每项技术转移都具有很高的风险,并且涉及严格的监管要求和对细节的遵守。如果不注意细节,不良转移的影响可能会产生严重而持久的后果。因此,专业知识和强大的项目管理是必不可少的。
成功技术转移的必要条件
无菌生产工艺的转移涉及许多开发步骤和挑战,特别是因为通常涉及多个合作伙伴和站点。其中包括发送单位(定义为指定产品、工艺或方法预期从中转移的组织)和接收单位(指定产品、工艺或方法预期接收转移并执行的组织)。
从监管的角度来看,与生产工艺的初始开发和设计相比,无菌商业化产品从一个洁净室到另一个洁净室的技术转移在时间和精力方面可能没有太大差异。因此,这种转移的范围由多方面因素决定,包括申报策略、监管机构的特殊要求,以及接受潜在的操作和系统变化、以实现最先进的工艺流程的承诺。
如何应对高工艺复杂性
风险很高,所涉及的流程很复杂,可能存在无法预见的挑战。一个好的起点是创建一个专门的团队,该团队具有处理工艺流程中多个领域的必要技能和专业知识。该团队应包括来自开发、生产、质量保证、法规事务、质量控制和质量确认/验证的专家。他们负责促进和执行流程,并与技术转移/项目负责人进行协调。必须就所有相关团队成员的角色和职责达成一致,并且必须建立一个确保信息充分沟通和反馈的系统,包括各方之间的保密协议。
任何工艺转移的开始都是工艺验证方法(图1),其基于美国食品和药物管理局(FDA)的行业指南:工艺验证:一般原则和实践。其目的是在接收站点始终实现稳健且可复制的生产工艺,并具有一致的质量。以下部分是技术转移的主要项目步骤。
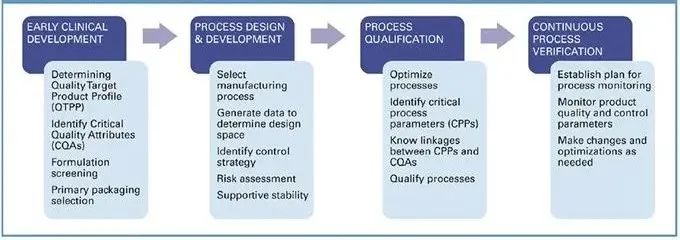
图 1. 针对技术转移和规模放大,专注于高精度和循证工艺开发的独特质量参数。
工艺开发。根据国际协调委员会 (ICH) Q8 (R2) 药物开发指南,成功的转移包括基于适当的相关文件和整体风险管理应用的初步综合工艺开发。对计划中的大规模生产过程中的潜在差距的评估以及推荐的开发实验室研究的推导,将有助于识别和评估转移站点之间的任何差异。此外,对生成的数据所致的操作范围的评估还有助于识别在工艺设计期间必须控制、以满足关键质量属性 (CQA) 的任何关键工艺参数。
工艺设计。通过药物产品开发获得的知识和规模放大活动的经验决定了生产工艺,以验证该工艺可为产品提供一致的质量。这是通过在接收站点实施控制策略来识别和控制材料和工艺的可变性来源来实现的。为了开发最合适的工艺,设计和监督技术批次和初始GMP批次,通过评估对质量属性的潜在影响来验证定义的操作参数范围,并对获得的工艺稳健性数据进行评估。最后,进行风险评估,以确定工艺参数对质量属性的影响。
工艺性能确认。在此阶段,对工艺设计进行评估,以确定它是否能够采用可重复的商业化生产方法。重新审视工艺设计数据、相关风险评估以及对支持指导工艺性能确认 (PPQ) 策略的已定义工艺参数的关键评估是必要的。此外,对 PPQ 批次进行监督,并根据预定义的验收标准评估数据。作为第一批商业化批次之前所需步骤的变更控制的协调也是关键。
持续的工艺验证。这最后一步确保在为市场供应而进行的常规商业化生产期间,该工艺保持在受控状态。基础是建立一个持续的程序,来收集和分析与产品质量相关的产品和过程数据。随着合格的工艺移交给负责商业化生产的制造和质量单位,技术转移就完成了。
总体而言,需要在多个领域拥有丰富的经验,包括深入了解 API 的性质以及稳定性测试期间可能出现的事件所导致的属性和配方。此外,申报策略的知识是必不可少的,因为一些国家对商业化有特定的要求,这些要求会影响工艺确认策略的范围,例如批量大小、保持时间等。监管限制也会影响生产的变化环境。此外,必须评估生产站点内或生产站点之间的流程信息交换(包括设备和设施、清洁和灭菌程序、输入参数和过程控制),并记录转移及其所有必须完成的合同、协议、报告和说明。必须遵守产品的过程中和放行规范,并与设计空间(即仍能保证产品质量的特定参数的公差水平)进行比较。
克服技术转移挑战
如前所述,成功的技术转移面临许多挑战。以下示例有助于说明合同开发和制造组织 (CDMO) 遇到的困难情况以及如何成功解决这些情况。
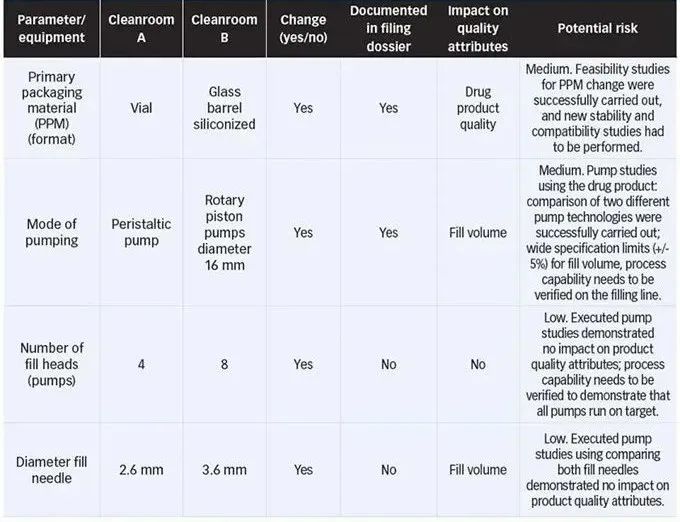
在第一个示例中,基于纸质差距分析(表 I),分析了两个洁净室工艺的生产步骤和设备差异(例如,初级包装材料的形式和制备)。预计初级包装材料将发生重大变化,因为药品从小瓶变成了玻璃桶。在这种情况下,玻璃桶的清洗和硅化、硅化水平/分布和顶出力在进入灌装线之前进行了分析。必须评估的两个主要差异是玻璃表面的硅化分布和通过确定松散和滑动力相互作用进行的含量/功能测试。此外,还对具有硅化水平的药物产品溶液进行了稳定性测试 - 与没有硅的小瓶相比。通过使用特定的分析方法,例如超薄层探测器和傅里叶变换红外光谱,结合测量的松散力和滑动力来评估分布是否满足要求,以保持新洁净室工艺生产的产品的功能性。此外,还进行了滞留量测定和可排出量的新设计,以满足从小瓶到玻璃桶过渡的新要求。由于这种初级包装材料的变化具有监管后果,因此必须提交和调整新的稳定性和相容性研究。
表 I. 最初的纸质评估(差距分析)是所有成功技术转移的基础,并为必要的预算、时间和资源提供指示。
在第二个示例中,根据从药品概况中得出的相关属性(包括外观、特殊物质、杂质和无菌性),确定了使用传统泵系统的混合过程、过滤过程和灌装技术的潜在风险。虽然这并不罕见,因为生产更多批次需要更大量的 API,但在这种情况下需要更大的复合设备。因此,进行了实验室试验,以支持为混合和后续过滤过程选择适当的操作参数。
除了体积的变化外,还需要分析泵送参数,因为体积和实施的较大变化导致需要适应洁净室内的灌装设置,涉及设备尺寸、过滤器尺寸、流体动力学以及使用的转移介质氮对药品灌装特性的影响。作为预防措施,灌装操作在氮气压力下进行,以尽量减少与氧气的任何潜在相互作用。在大多数情况下,注射器顶部空间中的氧气敏感性程度是未知的,因此未定义为规范。为了保持当前的氧气水平,在洁净室中额外使用了真空塞技术,以将气泡尺寸减小到尽可能小,作为第二个控制措施。因此,需要额外的工程运行来评估灌装管、灌装设备和灌装针的最佳尺寸,以适应增加的生产线速度,因为与此前的灌装线相比,新灌装线的灌装速度更快。由于药物产品溶液的这种新的流体动力学特性,有必要优化在线除菌过滤器的过滤速率以及洁净室中的转移力、氮气过压。最后,建立了优化的生产线设置、灌装设备以及与驱动力相结合的过滤单元,以执行稳健且受控的流程。尽管工程运行的缺点是额外的成本和时间以及更高的材料消耗,但它们的好处很多,包括在培训人员的同时获得更多的工艺理解和性能,在洁净室条件下进行的操作,产品可比性的证明、CQA 的验证等。此外,可以证明风险缓解工作,并且可以改进任何问题或生产说明。
第三个例子涉及灌装过程,其中药品溶液具有挑战性的流体特性。目标是确定接收洁净室中可用的合适泵系统。标准是实现尽可能高的准确性,建立受控流程,并满足关键的产品质量属性,如外观、颗粒物、杂质和可排出量。在这种情况下,两个带有旋转活塞泵和隔膜泵(图 2)的泵系统被确定为足够精确,可以通过支持产品质量数据来确保灌装。最后,出于时间角度的考虑,选择使用旋转活塞泵。当然,这些结果通过在大规模生产条件下的额外工程运行,进行了转移和验证。
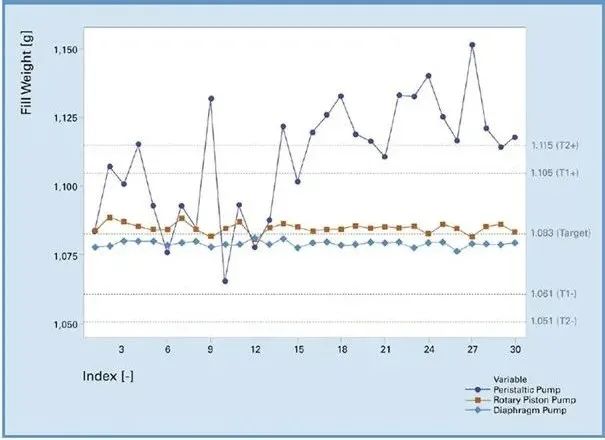
图 2. 在泵研究中,对多种设置和泵参数的适用性测试评估了对关键质量属性的潜在影响。
你在和合适的人一起工作吗?
由于其复杂性和高风险,公司通常依赖合格的 CDMO 的专业知识,后者在工艺开发和技术方面拥有相当丰富的专业知识,以实现从技术转移/规模放大到产品推出的支持。在以前的技术转移项目中获得的经验和数据也有助于缩短时间。
技术转移只有在接收单位可以根据与发送单位商定的一组预定义规格复制转移的产品、工艺或方法时才能算获得成功。因此,一个项目最终取决于分配给该项目的个人的技能和绩效以及转移团队的经验。接收单位的经验在药品、初级包装、工艺和组件方面也很重要,因为最初的差距分析是基于纸质的。进一步的文件记录是技术转移的关键要素,以确保技术转移和工艺运行的一致和受控程序。清晰的文档应提供工艺和产品知识的保证。
每次转移都必须尽可能减少更改,以使用现有数据并简化监管审批流程。只有这样,才能将合格的工艺移交给负责商业化生产的单位。






