生物制药行业使用许多复杂和创新的原材料,根据定义,这些原材料不属于药典。因此,这些原材料的控制由许可证持有人决定。直到最近,这种控制都是通过原材料供应商和零件ID的注册来定义的。
甚至在COVID-19大流行之前,这一战略就开始给供应链带来压力,因为它将采购限制在独特的供应商和独特的产品上。然而,在大流行期间和之后,如果制药行业希望继续向患者提供往往可以挽救生命的药物,这一战略已被证明不再有效。
纠正目前在工艺组件和材料供应方面的不灵活性是一个关键的行业优先事项,并与产品的注册细节有关。
本文提出一种基于质量源于设计原则的、注册创新和复杂原材料的最佳实践方法。它可应用于生产生物制品时使用的非药典原料的不同家族。
指引及规例
根据生产过程中原材料的使用地点和使用方式,多个指南涵盖了对原材料描述的监管要求。例如,国际协调会议(ICH) Q6B(Specifications: test procedures and acceptance criteria for biotechnological/biological products)包含对原材料和赋形剂规范的要求。
ICH Q11(Development and manufacture of drug substances (chemical entities and biotechnological/ biological entities))描述了关于生物技术/生物原料药来源和起始材料选择的监管期望。它介绍了材料对照的定义,但在生物制品注册方面遵循ICH Q5A(用于病毒安全性)、5B(用于细胞系)和5C(用于细胞底物)。
最后,ICH通用技术文件M4Q(质量)涵盖了提交材料的最低要求。
这些文件设定了高水平的期望,其具体实施将有所不同。
注册经验
当审查如何在监管申报中描述材料时,有许多做法。
正如我们上面所看到的,这通常是通过材料的名称和生物制药产品的供应商来完成的,这意味着替代采购是复杂的。典型的策略是使用新材料重新验证流程,然后通知或提交更改给不同的监管机构,以获得批准。这可能需要数年时间才能在全球范围内实现,从而造成供应链的延迟和中断。
然而,当材料由其功能和关键材料属性(CMA)定义时,策略变得更加灵活。根据ICH Q12(Technical and regulatory considerations for pharmaceutical product lifecycle management),这并不是因为需要较低的科学严谨性来证明更改的合理性,而是因为在实施之前不需要监管机构的事先批准。
等同的定义不随提案而改变。替代材料将被期望满足相同的预定标准,仍然可能需要多个批次,等等。本提案所提倡的唯一变化是,材料归档的方式允许满足相同CMA定义的对产品质量、安全性和有效性具有相同影响的相同功能的材料之间的灵活性。
过程概述
CMA在“Understanding Pharmaceutical QbD”中定义为“输入材料的物理、化学、生物或微生物性质或特征,应在适当的限度、范围或分布内,以确保原料药、赋形剂或过程中材料的所需质量”。
BioPhorum方法提供了一种基于QbD原则识别这些CMA的简单而系统的过程,包括四个步骤:
定义目标材料概要文件(TMP)。
描述材料属性。
审核产品汇总控制策略。
识别CMA以确保产品质量和安全。
然后遵循的原则是,原材料是通过其CAM在提交中注册的,以允许:
通过对那些对产品质量至关重要的原材料属性的明确理解,增加供应的灵活性,
提高监管提交的质量,以及
可能改善产品和工艺的稳健性。
该方法允许通过其CMA定义原材料,CMA可以注册为与原材料和/或EC相关的控制策略的一部分。它的好处包括:
通过增强对产品和工艺的知识和理解,增加供应的灵活性
通过展示产品和工艺知识和理解来提高监管申报的质量
通过CMA的定义和控制改进产品和工艺过程的稳健性。
对于审查和批准生产授权的机构也有好处,例如:
提高监管提交的质量
如果批准后的变更可以记录在生物制造商的PQS或产品年度报告中,则减少通知/补充的数量。
步骤描述
步骤1:TMP的定义
在这种方法中,我们将TMP定义为“在理想情况下将实现的材料特性的前瞻性总结,以确保所需的原料药和/或药品质量和安全,以及/或工艺性能。”换句话说,就是材料所扮演角色的描述。”
TMP建立在:
预期用途:定义该材料要发挥的作用。
质量标准:材料对产品质量和工艺性能的影响。
安全标准,例如可能伤害患者的潜在污染物的影响。
其它要求:通常需要确保实际的产品生产。
步骤2:材料属性的描述
这涉及到理解材料特征的不同变量。这些可能包括化学属性(如建筑材料)、物理属性(如几何形状)、微生物属性(如无菌)和其它安全属性(如杂质)。
第三步:审查产品控制策略
在QbD提交中,产品和工艺知识和理解被总结在汇总控制策略中。
控制策略是该提议的先决条件,因为它描述了质量如何构建到生产过程中,以及放行测试如何是产品质量的验证,而不是保险。它还描述了过程控制对下游工艺的影响,从而提出了产品质量的整体方法。
步骤4:定义确保产品质量和安全所需的CMA
TMP、材料属性和汇总控制策略都有助于理解在特定工艺步骤中使用的材料中什么是重要的,以及什么可以被定义为原材料CMA。
通过对步骤2中确定的材料属性、它们对TMP和/或产品控制策略的影响的系统审查来确定这些。影响评分描述如下:
低影响:基于产品和工艺知识和理解,该属性对TMP或与材料及其使用相关的控制策略没有贡献。不需要更多的描述。
中等影响:基于产品和工艺知识和理解,该属性可能有助于TMP或与材料及其使用相关的控制策略。该属性与其它属性结合时,对产品质量和工艺性能产生影响。中等影响的材料属性可能需要控制。
高影响:基于产品和工艺知识和理解,该属性直接有助于TMP或与材料及其使用相关的控制策略。
高影响属性被定义为CMA。这些要求定义控制 (适当的限制、范围或分布),以确保输出材料的期望质量。CMA或极限、范围或分布均不应改变以证明等效性。
中等影响属性不定义为关键,但它们需要控制,因为当与其它更改结合时,它们可能会影响产品质量和过程性能。它们通常是预评估或验证研究的一部分。
注册策略
当上市许可持有人选择使用这种方法来定义原材料时,图1根据材料的使用地点和方式提供了关于通用技术文件(CTD)中所需信息的建议。
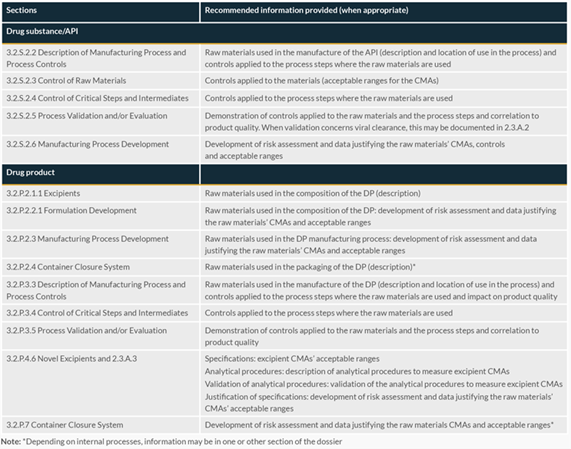
图1:CTD中与原材料相关的信息位置
既定条件
ICH Q12将EC定义为确保产品质量所必需的、具有法律约束力的信息。因此,CMA被定义为原材料的EC。定义的EC的变化被认为是产品质量的潜在重大变化,因此需要事先获得监管机构的批准。
报告的类别
根据ICH Q12,已批准EC的变更通过以下方式向监管机构报告:
提交适当的批准后监管文件,说明并论证对已批准EC的拟议修订。论证可能包括验证数据和批次分析等信息。
在原始上市许可申请中或作为批准后提交的一部分,提交批准后变更管理方案(PACMP),说明对EC或报告类别的修订,以及如何对变更进行论证和报告。
酌情使用批准后的监管承诺。
这种事先批准的过程会导致时间延长和供应链中断。但是,如果EC没有改变(例如,两种不同来源的材料实现了相同的CMA),则不需要事先批准,因为改变对产品质量没有潜在的重大影响,从而允许快速实施和供应的灵活性。
该方法没有为潜在的重大变更提供“免费通行证”,但允许许可持有人通过基于风险的方法关注对产品质量至关重要的领域。它还允许他们设计强大的可制造性研究,确定适当的控制,并主要在其药品质量体系(PQS)中报告他们的工作。如有需要,变更将在产品年度报告或适度变更通知中报告,而不是在实施前需要监管机构审查和批准的批准后补充。
批准后变更管理方案
ICH Q12还将PACMP定义为一种工具,可将批准后的变更及其报告类别最小化。
作为一种证明对产品质量没有影响的适当手段,PACMP被审查并与监管当局达成一致。这些方案和接受标准都是预先批准的。
因此,如果原材料没有传统的注册(例如,通过其供应商和零件ID),这点就特别有用。或者,如果要改变EC,它们可以将变更类别从重大减少到适度,从而缩短审批时间,从而限制供应链的延迟和中断。
结论
该提案旨在启动生物制品行业原材料注册的转型变革。实施这些建议有望为产品控制策略(包括CMA)的注册带来不同的方法。






