浅析抗体偶联药物ADC(附常见Linker名称及结构式大全)
2022-04-28 09:31:58
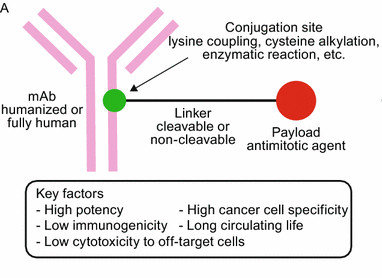
抗体作为治疗药物的研究和临床应用由来已久。1975年,Kohler和 Milstein在小鼠中发明了杂交瘤技术(Hybridoma technique),单克隆抗体 (mAb) 疗法开始崭露头角。1986 年,Greg Winter开创了单克隆抗体人源化技术。在此之后,数个治疗性单克隆抗体药被研发出来用于各种癌症的治疗。而随着抗体技术在过去几十年中的逐步提升,抗体偶联药物也进入了快速发展期。抗体偶联药物(Antibody-drug conjugates,ADC)是一类融合了抗体与小分子细胞毒素两种组分的新兴药物。其中抗体提供细胞靶向性,可以将药物比较精准的输送到靶细胞,最大限度地减少对正常组织细胞的毒性,因此在肿瘤治疗以其他领域如免疫、抗感染等都具有非常广阔的应用前景。Nature Reviews Drug Discovery预计,全球ADC药物市场将在2026年达到160亿美元。ADC药物由人源化/人源单克隆抗体(mAb)、细胞毒性荷载(Cytotoxic payload或warhead)以及连接子(Linker)三部分组成,抗体通过连接子与细胞毒性药物偶联,共同赋予ADC细胞靶向性和杀死细胞的效力。图片来源:Tsuchikama et al, Antibody-drug conjugates: recent advances in conjugation and linker chemistries, Protein & Cell 9(1), 2016
抗体
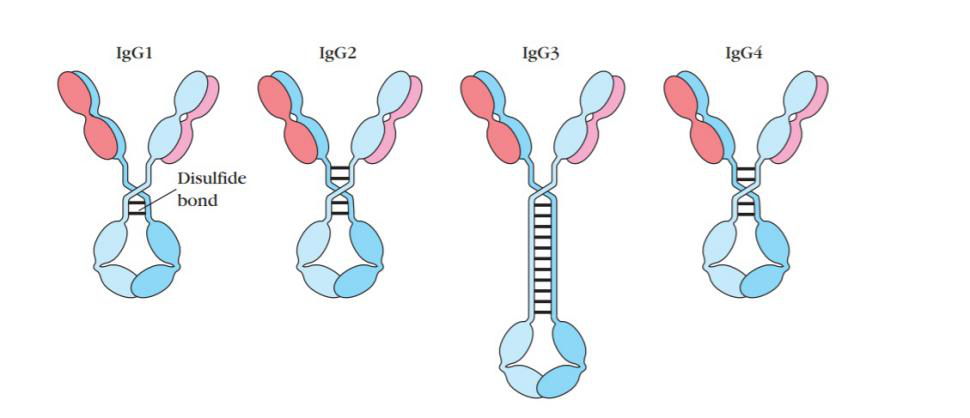
抗体相当于ADC药物的“制导装置”,通过与肿瘤细胞表面特有的抗原结合来实现ADC特异性杀伤肿瘤细胞的效果。mAb依据其靶点的不同可以在体内发挥多种作用机制:靶受体中和和下调、阻断信号传导、免疫检查点抑制、和抗体介导的细胞毒性等。为了最大限度地减少脱靶毒性,理想的靶点抗原应在肿瘤细胞(或其他靶细胞)上均匀的高水平分布,而在健康的组织细胞中却不表达或低表达。比如上市的ADC药物常用的四个靶点抗原CD22、CD33、CD30 和 CD79都是只在靶细胞中表达。而且,抗原最好也不易从靶细胞上脱落,否则当它们游离在循环系统中会与抗体结合而消耗ADC,从而使大部分药物达不到目标组织。此外,为了实现最低的免疫原性,mAb通常选择人源化或全人源的抗体。人体内的抗体可分为五类:IgA、IgD、IgE、IgG和IgM(Ig,Immunoglobulin免疫球蛋白),它们的重链结构不同,并具有不同的效应器功能。IgG又可以进一步细分为IgG1、IgG2、IgG3和IgG4,它是在临床治疗中被最广泛应用的一类免疫球蛋白。IgG 抗体由两条重链和两条轻链组成。它有两个介导抗原识别的抗原结合片段 (Fab) 和一个介导抗体与免疫系统效应细胞结合的恒定片段 (Fc)。而Fab中包括的Fv 片段是抗体的最小结合单位,由轻链和重链可变结构域组成,两条链通过柔性肽接头连接在一起。细胞毒性荷载
细胞毒性荷载(Cytotoxic payloads)是 ADC 中真正起到疗效的成分,这些荷载在被水解切割之后成为活性很强的药物,因此也被称为warhead(弹头)。目前 抗肿瘤ADC 药物开发中常用的细胞毒性荷载主要集中于两种:一是DNA损伤药物,一是微管蛋白抑制剂。除了细胞毒性外,能作为有效载荷的药物在选择时仍需考虑其共轭性、溶解性和稳定性。药物分子结构应易于与连接子结合,此外,由于 ADC通常是经静脉给药,因而药物的可溶性和血液中的长期稳定性也至关重要。药物抗体比(DAR),即连接在单抗上的药物分子数量,DAR决定了ADC药物的的药代动力学、药效力和毒性。在传统的随机药物偶联策略中,不同DAR值的药物是混在一起的,每个抗体的 DAR 可能在 0 到 8 个细胞毒性有效载荷之间变化。DAR的异质性会导致药代动力学、功效和安全性的异质性,会产生药物结构不稳定、脱靶毒性增加、药物聚集等不利于后期研发的问题。因此,为了使DAR纯度更高,位点特异性偶联 (SSC) 的策略被采用,这些策略包括:工程化半胱氨酸残基的插入、抗体序列中非天然氨基酸的插入、通过糖转移酶和转谷氨酰胺酶的酶促结合等。连接子
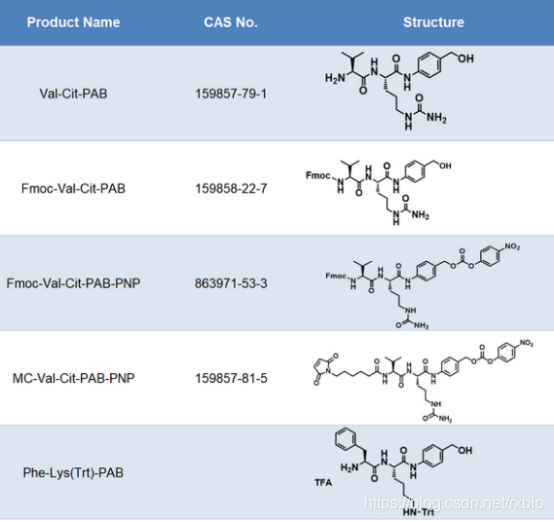
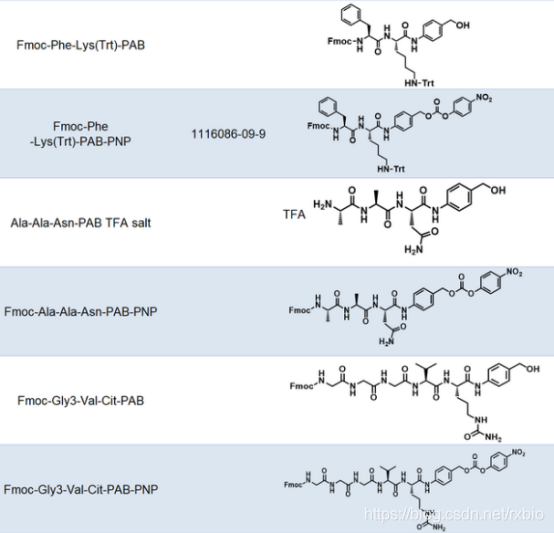
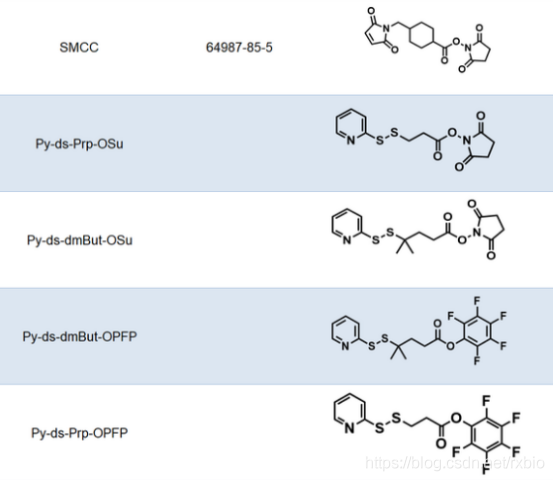
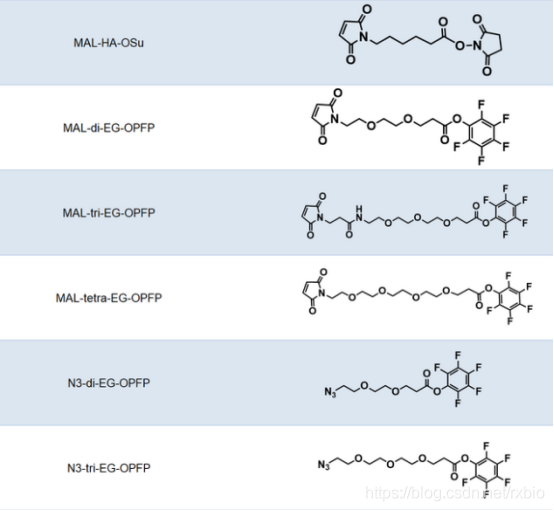
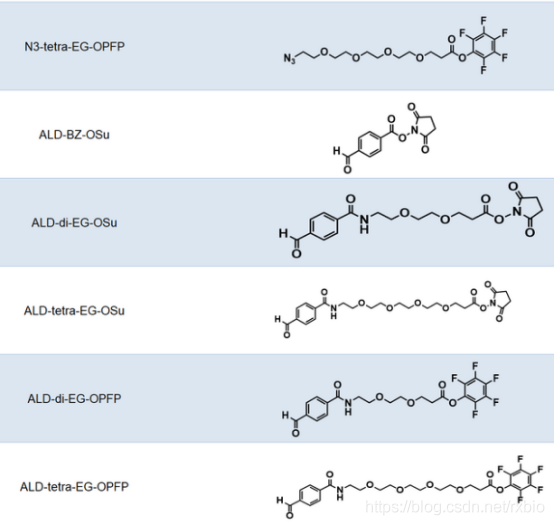
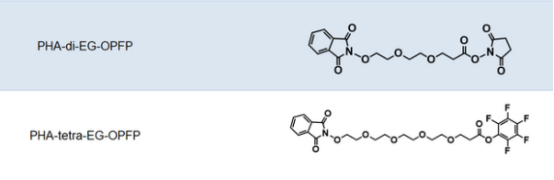
连接子(Linker)是将细胞毒性荷载与单克隆抗体相连接的化学结构。从成本和生产难度考虑,连接子首先要易于与抗体和荷载进行连接,此外,建立的这种共价连接既需要在循环系统中保持稳定,又需要在靶细胞的内吞作用之后容易被水解从而释放药物有效组分。此外,连接子虽然不长,但是也会一定程度的影响ADC药物的药效学和药代动力学特性。当抗体介导ADC到达细胞之后,ADC通过细胞内吞作用进入,连接子与细胞毒性荷载的连接处通过水解等方式被切断,从而释放出细胞毒性物质以便其行使功能。按照连接子在细胞内的水解方式,可以将其分为可切割和不可切割两类。可切割连接子是通过细胞中的生理条件来释放细胞毒性物质的,依据细胞内环境的不同又可以进一步细分为酸敏感、蛋白酶敏感或谷胱甘肽敏感的可切割连接子。而不可切割的连接子只有借助细胞的溶酶体中才能被降解,因而,相比于可切割的连接子,不可切割连接子ADC药物在血液中具有更长的半衰期和更低的脱靶毒性。下图为常见的ADC linker的名称及结构式大全
图片来源:瑞禧
/02/
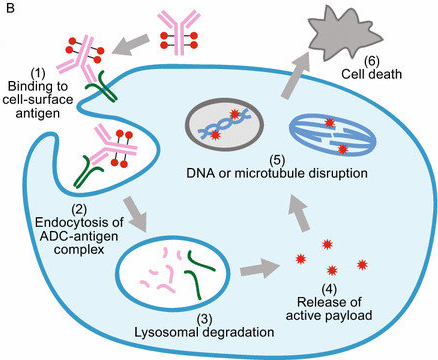
ADC药物作用机制
ADC的三组分结构让它的作用机理也非常直观。ADC在血液循环中,首先由其抗体引导特异性靶向癌细胞(1),当ADC与癌细胞表面的抗原结合之后,通过抗体介导的内吞作用进入细胞(2),在内体中(可切割连接子)或与溶酶体融合后(不可切割连接子)通过酸性条件或水解酶等释放细胞毒性物质(3&4),这些微管抑制剂或DNA损失物质进入细胞质或细胞核中与靶分子结合(5),进一步诱导细胞凋亡(6),从而达到杀死癌细胞的效应。图片来源:Tsuchikama et al, Antibody-drug conjugates: recent advances in conjugation and linker chemistries, Protein & Cell 9(1), 2016/03/
市场前景
仅2020一年,全球ADC药物市场规模即达到 43 亿美元,预计到 2028 年市场将以 24% 的复合年增长率持续增长。新靶点的发现、抗体工程和连接子技术的进步带动了ADC药物研发和临床应用的快速发展。庞大的市场需求也吸引了大量的研发投资在这个领域,预计到2025年全球癌症发病率将达到 2190 万,而到 2030 年将达到 2460 万。ADC因为结合了抗体的特异性和抗癌药物的杀伤细胞能力,因而被认为是极具潜力的抗癌靶向药之一。全球目前已有13个ADC在FDA获批上市,100多个ADC产品处于临床期的不同阶段。经过了三次的迭代,ADC技术日趋成熟,公司间的竞争更趋于平台的差异化竞争。此外,基于新靶点的药物研发也如火如荼的进行。ADC靶点选择从传统的HER2、CD30 等不断向新兴靶点 Claudin-18.2、ROR1、TF 扩展。目前在临床前或临床开发期作为ADC药物靶标的有超过 50 种不同的已知抗原。在国内,目前已有30多家企业布局了ADC产品管线,其中40多款产品已进入临床试验阶段。首个国产的ADC药物,荣昌生物的HER2 靶向药RC48也已于2021年6月获批上市。通过引进国外技术平台或开发自有平台的方式,国内企业正在逐步缩小与国际领先水平的差距。目前已上市的ADC药物在全球销量都呈现出良好的增长趋势,以巨大的市场需求和技术的日趋成熟作为后盾,先突围而出的企业必将引领行业进入快速增长期。