随着人类的进步和发展,越来越多前沿科学研究正在走进人们的日常生活,不断为人们所知、不断为人们所用。近几年,一类纳米尺寸的细胞囊泡——外泌体(exosome)受到了科学家们的广泛关注。
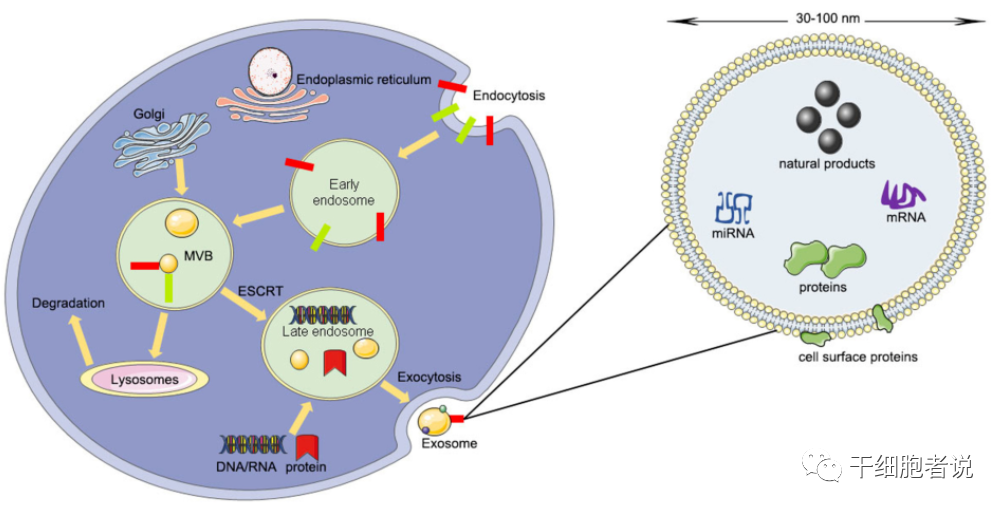
图1 外泌体的生物来源过程和结构
外泌体,一种直径约30-150nm的纳米级囊泡,起源于细胞内吞过程中形成的内体,再从细胞中释放到胞外。几乎所有细胞都可以分泌外泌体。如果这个外泌体恰好是干细胞分泌的,那就叫干细胞外泌体。如果是肿瘤细胞分泌的,那就叫肿瘤细胞外泌体。
2013年,外泌体因诺贝尔医学奖而被众人知晓,也因此将外泌体研究推向了前所未有的新高潮。外泌体在体液中广泛存在及易获得性等特点被誉为液体活检"新秀",成为疾病的精确诊断和治疗研究的热点。
外泌体于1983年首次在体外培养的绵羊红细胞上清液中发现且能被多种细胞分泌。最初,外泌体被认为是细胞成熟过程中调节膜功能而释放的多余膜蛋白,是清除细胞碎片和淘汰细胞表面分子的细胞器。直到后来,科学家们才发现外泌体在细胞之间充当重要的沟通介质,进而影响细胞而至组织的生理活动。
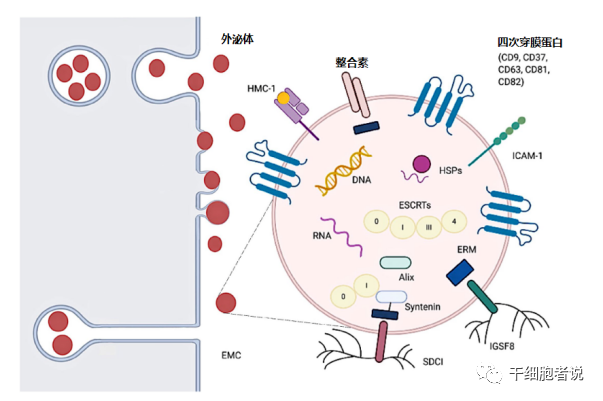
图2 外泌体从核内体和质膜中萌发
细胞外囊泡(extracellular vesicles, EVs) 是机体远距离细胞间交流的一种手段。目前主要被分为3大类:外泌体、微囊泡和凋亡小体,临床研究中主要关注的是外泌体。外泌体就是细胞外囊泡的一种。自此,外泌体研究成为国际研究热点,相关研究驶入快车道。据统计,Pubmed收录的外泌体研究相关文章数量呈逐年递增态势,一路高歌猛进,呈现暴风增长。我们带大家探索一下外泌体目前最火热的研发方向。
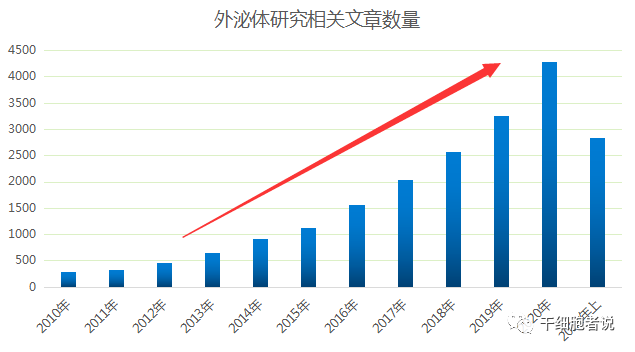
图3 近十年外泌体研究相关文章数量
干细胞外泌体成为研究热点可能得益于干细胞研究的蓬勃发展。间充质干细胞外泌体(MSC-exo)具有免疫调节、抗炎和抗纤维化、抑制氧化应激、增强血管生成等作用。这主要依赖于其中的蛋白和核酸组分。例如MSC-exo富含糖酵解相关酶,可增加ATP的产生,减少组织细胞死亡,还含有细胞因子(VEGF、TGF-β1、IL-6、IL-10和HGF等),有利于血管生成和免疫调节。
2018年5月,FDA批准了Aegle公司的首个细胞外囊泡新药临床试验申请,以开始用于烧伤患者的临床试验。通过分离纯化MSCs分泌的细胞外囊泡,用以治疗严重的皮肤病,包括烧伤和大疱性表皮松解症。
2019年6月,United Therapeutics宣布其基于外泌体治疗支气管肺发育不良(BDP)的 I 期试验获批开展。
2020年1月,Exopharm宣布了其在人类临床试验中的首次给药,成为首家测试外泌体对伤口愈合能力的公司。Exopharm的Plexaris产品,是无细胞的血小板外泌体制剂,在临床前动物研究中,改善了伤口闭合,并减少了疤痕。
干细胞外泌体可促进皮肤创面愈合:促进创面局部巨噬细胞从促炎M1向抑炎M2型转变从而有助于组织修复,抑制肌成纤维细胞分化和过度纤维化,从而减少瘢痕形成。间充质干细胞(MSCs)通过旁分泌效应,将携带细胞因子和核酸等信号的外泌体传递至邻近的目标细胞,促进损伤部位修复。
所有的细胞都可以分泌外泌体,机体的体液内和间质中均含有大量的外泌体。外泌体被认为是疾病诊断的无创或微创生物标志物,具有检测包括癌症在内的许多病理状况的潜力。
个性化和精准医学的检测,通常会使用体液(主要是血液和尿液)的液体活检正迅速受到关注,不但方便且对患者伤害甚微。在液体活检中主要分析循环肿瘤细胞(CTC)、游离DNA(cfDNA)和外泌体。外泌体因稳定性高并易于从尿液或血液中收集,是开展液体活检的最佳候选者。
miRNA在机体内起着调节作用,故被认为有诊断的生物标志物的潜力,外泌体miRNA富集的变化可反映生理病理的改变。肿瘤特异性循环外泌体miRNA已被开发为肺癌的早期诊断生物标记。据报道,miR-23b-3p,miR-10b-5p和miR-21-5p是非小细胞肺癌(NSCLC)患者有希望的预后生物标志物。同样,外泌体也包含来自宿主细胞的蛋白质,因此也具有潜在的生物标志物来源。除了miRNA、蛋白质外,来自癌症患者的外泌体lncRNA还被定义为新型肿瘤生物标记物。
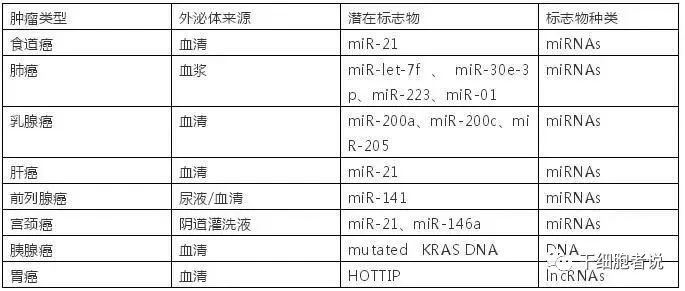
图4 外泌体内容物作为肿瘤的潜在诊断标志物
眼下,外泌体似乎已经成为下一个生物医药的黄金赛道。科学家们普遍认为,外泌体具有其独特的生物学特征,可以作为一种药物递送载体。外泌体已经成为基因治疗的潜在载体,纳米尺寸和柔韧性使它们能够跨越主要的生物屏障,如血脑屏障(BBB)等。与脂质体制剂相反,外泌体是天然存在的外分泌型膜囊泡,毒性较低,人体耐受性很好。另外,外泌体的归巢能力暗示了它们在药物递送中的潜在效用。例如,源自黑色素瘤的外泌体优先进入前哨淋巴结,这种归巢能力可以用作药物的靶向递送。
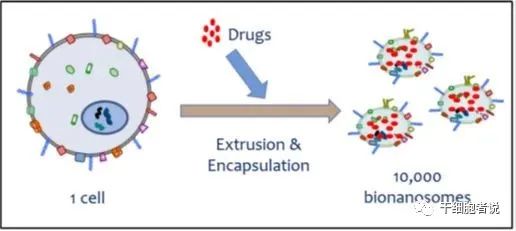
图5 外泌体可用于药物递送
外泌体天然适于运输蛋白质、mRNA、miRNA、各种非编码RNA、线粒体DNA以及基因组DNA。利用这一点,外泌体可用于递送siRNA及其他药物(如亲脂性小分子)。比如将抗炎剂姜黄素、抗癌剂阿霉素和紫杉醇等装载到外泌体中用于相应疾病的治疗。
基于外泌体的药物递送系统在癌症的治疗中具有极大优势,能使得免疫原性和毒性最小化。研究表明,基于外泌体递送系统的阿霉素的治疗功效大大增强,并且对主要器官系统(尤其是心脏)的不良影响明显减少。
外泌体具有诸多优点,在疾病治疗中具有难以忽视的价值。人们对探索肿瘤中免疫失调很感兴趣,其中包括基于外泌体的肿瘤免疫疗法,这有望诞生抗癌疫苗。
肿瘤来源的外泌体可携带抗原,并已被用作针对肿瘤的免疫反应的特异性刺激来源。B细胞分泌的外泌体,表达了MHC-II,从而激活了CD4+T细胞,而DC细胞分泌的外泌体表达了MHC-I,从而激活了CD8+T。这些免疫细来源的外泌体可以在临床前试验和人体试验中展示了可诱导抗肿瘤免疫力,包括结肠直肠癌、转移性皮肤癌和非小细胞肺癌等。在I期临床试验中,用DC外泌体治疗晚期非小细胞肺癌/转移性黑色素瘤患者,显示出抗肿瘤免疫应答和肿瘤消退。在恶性神经胶质瘤患者中,负载有肿瘤外泌体的DC细胞有效地产生了针对自体肿瘤细胞的抗肿瘤反应。腹水来源的外泌体与DC细胞/肿瘤细胞外泌体一样有效,可敏化DC细胞和CTL细胞,从而在体外杀死自体肿瘤细胞。结直肠癌患者的腹水来源外泌体与GM-CSF联合可以有效地诱导晚期结直肠癌患者有效的CEA特异性抗肿瘤免疫力。
肿瘤来源的外泌体也表现出强烈的促肿瘤免疫反应。肿瘤细胞外泌体可以抑制T细胞和NK细胞活化,且促进Treg细胞功能(如携带PD-L1的肿瘤细胞外泌体可以抑制T细胞功能促进肿瘤生长)。除了Treg细胞外,肿瘤细胞外泌体还能抑制DC细胞活性并促进MDSC细胞的扩增。肿瘤细胞来源的外泌体也刺激巨噬细胞向促进癌症的M2期极化。
因此,外泌体在癌症治疗中是一把双刃剑,同时发挥免疫激活和免疫抑制功能。免疫激活作用主要取决于外泌体的抗原呈递,免疫抑制作用主要取决于其携带的配体(如蛋白质和miRNA等),可以抑制CTL细胞的活性或促进免疫抑制细胞增值。唯有知己知彼,方可百战不殆。
随着技术的进步,外泌体已经越来越被人们熟知,其应用也愈加广泛。外泌体是具有纳米尺寸的细胞囊泡,具有高生物活性,能参与细胞之间的交流,调控炎症水平、促进组织再生。
如今,众多企业正在开发外泌体治疗或诊断方法,针对纯天然和工程化的外泌体产品进行临床试验。一点也毫不奇怪,许多细胞企业也在向外泌体领域拓展。迄今为止,全球约有40多家外泌体治疗和诊断的公司。

基于外泌体治疗的部分企业

基于外泌体诊断的部分企业
目前,国内外相关的研究正如火如荼地进行中。外泌体药物生产工业化(规模、纯度、成本、一致性和标准化)是目前面临的重大挑战。相信未来几年,从事外泌体产品开发的项目或企业将不断增加,最终外泌体产品将走向商业化,造福患者。
参考资料:
来源:干细胞者说
撰文:南宫明月






