问题 HCP
业界非常清楚细胞中产生的这些“搭便车”蛋白的多样化组合,并且在 DSP 纯化步骤中没有完全去除。如果 HCP 水平远低于建议的 100 ppm,我们如何仍然可以确定该池中不会存在会导致产品降解的特定 HCP?在开发高产哺乳动物细胞系时,Dorai 等人指出,融合蛋白的 N 端部分在 USP 过程中容易发生蛋白水解降解,从而导致产物失活。已显示与特定 mAb 共洗脱的组织蛋白酶 D 等痕量水平的蛋白酶 D通过裂解 mAb 产生 C 末端重链片段,影响最终药物产品在给药于患者之前的稳定性。据报道,其它几种蛋白酶(例如金属蛋白酶家族)会影响重组 CHO 细胞中产生的治疗性蛋白质的质量。
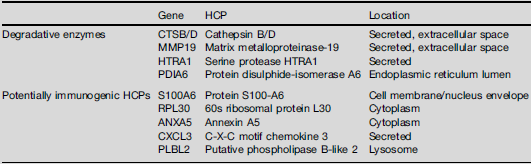
表2. mAb 生物工艺中常见的问题宿主细胞蛋白列表
甚至更糟的是患者的免疫原性,即使是低水平的 HCP 也有可能诱发有害的免疫反应。最近的一个案例强调了抗 HCP 抗体可能产生的潜在影响;在 lebrikizumab 的 II 期临床试验期间,90% 的患者对与 mAb 产品共纯化的 CHO HCP 磷脂酶 B 样 2 (PLBL2) 产生了特异性且可测量的免疫反应。开发商对下一阶段临床研究的生产方案进行了修改,以试图降低 CHO PLBL2 水平。PLBL2 在临床开发中与几种抗体共纯化,表明这是这一广泛治疗类别的潜在问题。随后的测试表明,它在临床批次中的水平存在 10 倍的可变性 (34–328 ng/mg),强调了批次之间的 HCP 杂质可变性问题,以及对更具体、更可靠的检测方法的未满足需求。据报道,这种持久的、难以去除的 HCP 还会导致最终药物制剂中使用的聚山梨醇酯发生酶促水解,释放出可在药品溶液中形成颗粒的脂肪酸。
通过各种 HCP 分析研究,一些常见的“有问题的”HCP CHO mAb 生物工艺被反复识别(表 2)。
那么最终药品中可接受的 HCP 水平是多少?最近基于 MS 的识别和量化方法使我们对 HCP 种群有了更深入的了解,并允许建立一种基于科学和风险的方法,以便在 QC 放行时为 HCP 制定更好的指南。结合更好的分析技术,蛋白质组数据库和计算机工具可以帮助进行风险评估,并帮助确定 CHO 蛋白的免疫原性潜力。值得注意的是 CHOPPI,这是一种专门为分析基于 CHO 的蛋白质疗法中 HCP 的免疫原性风险而开发的网络工具。
目前的鉴定方法
虽然行业的重点是开发上游和下游的新方法,以减少 mAb 生物工艺中 HCP 的数量,但 HCP谱中包含的蛋白质的丰度和多样性也对跟踪和识别提出了不同的挑战。
存在多种旨在监测、检测和测量整个 mAb 生物工艺和最终药物制剂 QC 放行的 HCP 的方法,但目前最常用的是免疫学测定,例如酶联免疫吸附测定 (ELISA)(表 1)。
表1. HCP 识别和跟踪方法

采用蛋白质组学方法的替代方法,如液相层析 (LC) 与质谱 (MS) 和二维凝胶电泳 (2D-DIGE) 与荧光染色相结合,能够识别和量化特定的 HCP。最终,这些技术的组合将提供最强大的工具来实现 HCP 鉴别。
在上游工艺的早期实施这些分析技术可以帮助创建一个稳健的工艺,最终允许低水平的 HCP 进入下游纯化过程。Jin 等人在蛋白质组学研究中使用 2D-DIGE 监测上游工艺参数的影响,例如细胞培养基、补液策略、生物反应器控制策略和收获时的细胞活性,以改善 HCP 概况。该数据表明,细胞活性对 HCP 特性产生了最显著的影响。
在考虑使用哪种蛋白质组学平台对 mAb 样品中的 HCP 进行分析时,必须注意 mAb 浓度通常明显高于 HCP 物质。由于 mAb 肽的强度偏差,当 LC-MS 在数据依赖采集 (DDA) 模式下运行时,这些低强度 HCP 肽未被选择用于碎裂。使用数据独立采集(DIA)模式更适合低丰度HCP的检测和定量。
Kreimer 等人最近开发了一种新型自动化 DIA-MS 工作流程,用于通过结合靶向和非靶向数据处理来鉴定 HCP 肽,以确保总 HCP 覆盖率,然后使用平行反应监测 (PRM) 进行验证和定量。在这项研究中,作者使用靶向策略补充了以肽为中心的 DIA 数据分析,在该策略中,DIA 数据通过 DIA-Umpire 转换为伪 DDA 数据,允许识别靶向分析之外的其它肽。使用这种 1D-LC-MS 方法,可以快速鉴定掺入 DSP mAb 样品 (0.5–100 ppm) 的低 ppm 水平标准品的无标记定量。
Chiveton等人使用定量 iTRAQ 蛋白质组学来跟踪产生 mAb 的 CHO-S 细胞系的 HCP 图谱,以提供收获时和后续下游工艺中 CHO HCP 的全面图谱,获取关键 HCP 的知识。来自该研究的数据表明,HCCF 中可检测到的大多数 HCP 在分析的层析洗脱液(Protein A、阳离子和阴离子交换)中都是可检测的。该跟踪研究的结果可用于帮助开发纯化步骤以及设计特定于关键 HCP 的检测方法。
结论
了解 HCP 含量和组成对于 mAb 生物工艺至关重要。HCP 分析领域近年来引起了相当大的关注,因为我们不仅需要量化而且还需要识别存在的特定 HCP。自第一个治疗性 mAb 获得批准以来的 30 多年里,很少有最终产品含有足以引起关注的水平的残留 HCP 杂质。
这主要是由于蛋白质组学技术的进步,使我们能够轻松监控、跟踪和识别有问题的 HCP。现在,我们的注意力转向使用生物信息学工具进行基于科学的风险评估,最终目标是确保患者安全和风险管理,以确保没有不良影响。
关键问题总是会回到药品的安全性、质量和功效上。我们知道,某些酶促 HCP 可以改变药物的药代动力学,从而改变产品的安全性、质量属性及其整体疗效。持续的分析过程将有助于填补这些问题 HCP 的知识空白。最终,生物工艺技术的进步需要推动 DSP 的创新,以根据科学和风险评估采用在正确时间进行正确分析的 QbD 理念,确保将其从工艺流中完全去除。
原文:S. Gilgunn, J. Bones, Challenges to industrial mAb bioprocessing—removal of host cell proteins in CHO cell bioprocesses. Current Opinion in Chemical Engineering 2018, 22:98–106.






