当前的细胞疗法生产基于手动或最多半自动工艺过程,其中包括在非封闭的设备进行中的步骤,因此需在生物安全柜中进行。它涉及巨大的洁净室占地面积、大量熟练操作员的时间以及潜在不一致的风险。下面描述的新细胞培养自动化概念的共同目标是在降低成本的同时,解决可放大性和质量问题。自动化还将为全数字化流程腾出空间,其数据允许在工艺开发期间更快地优化工艺以及自动化过程控制,包括使用 AI 在基于入线或近线过程监控系统的生产过程中,适应患者样品的多样性。
GMP 盒 (N=1, 10) vs. 生产线 (N=100+)
除了当前的手动或半手动工艺之外,行业还提出了细胞疗法生产自动化的三个主要概念(图 7)。
当前的标准是使用 Wilson Wolf(美国明尼苏达州圣保罗)的 G-Rex 或 Cytiva的 WAVE 生物反应器等系统进行工艺开发和放大。然而,很多其它制造商开发的产品往往缺乏自动化以及与用于其它工艺步骤的系统的集成,这使得它们的运行成本很高,并且可能会导致不一致。
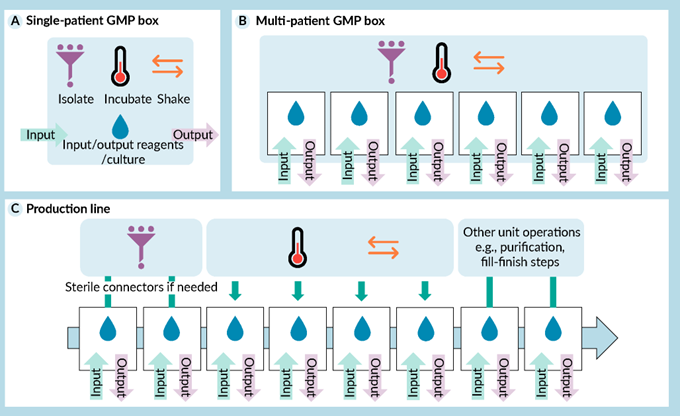
图 7 细胞治疗生产自动化的架构概念。A) 一次适合一名患者的单盒 GMP 生产装置。B) 具有适合生产多个患者的、共享资源的生产单元。C) 适合大量患者生产的可定制生产线
ScaleReady(美国明尼苏达州圣保罗)是 Biotechne(美国明尼苏达州明尼阿波利斯)、Fresenius Kabi(巴特洪堡)和 Wilson Wolf 的合资企业,它提供了一个细胞疗法生产平台,结合了现有的几个G-Rex 生物反应器外围设备用于扩展,并试图缓解其中的一些挑战。这套工具包括 Lovo 旋转膜过滤装置、用于小体积细胞处理的 Cue、用于基于转座子的基因转移的 Tc Buster 以及 GMP 试剂和培养基。
Miltenyi 的 Prodigy 也提供一定程度的集成(特别是在基于磁性的细胞分离和扩增步骤之间)和自动化。还开发了入线电转技术的整合。然而,用户正在寻求更先进的现成机器,下文所述的新一代仪器的测试版现已上市。
一种更集成的方法依赖于独立的、功能封闭的自动化“单一患者 GMP 盒”系统,类似于全功能个人计算机(图 7A)。它最初侧重于筛选和扩增,并逐步集成更多步骤。 Lonza 的 Cocoon 是典型的例子。其主要竞争对手 Ori Biotech(英国伦敦)正在开发一种基于由柔性材料制成的压缩容器的专利方法。该公司最近与Cell Therapy Manufacturing Center(美国德州休斯顿)合作,后者是德克萨斯大学 MD 安德森癌症中心和 National Resilience(美国加州圣地亚哥)的合资企业。Adva Biotech(以色列耶路撒冷)最近通过 Lonza 的许可解决了知识产权问题,该公司也提供了一种自动化的圆锥形可压缩生物反应器。该公司已经展示了包含来自多个集成传感器的数据的结果。 Limula(瑞士 La Tour-de-Peilz)的细胞治疗盒设计涉及一个生物反应器,该反应器包含两个同心可旋转腔室。Lupagen(美国德州Coppell)的目标是直接在患者床边生产 CGT,尤其是 CAR-T,Adva、Lonza 的 Cocoon、Ori Biotech 和 Limula 也有可能这样做。一旦这些系统都成熟了,比较它们的综合基准将非常有价值。据我们了解,目前只有Lonza的系统可以整合到 GMP 细胞疗法生产中。
第二种更大规模的方法是进行一定程度的规模放大和集成,以及一个可以并行管理大约 10 到 20 个独立剂量生产的系统(图 7B),类似于具有某些共享功能的小型集群或本地计算机网络。Cellares(美国加州旧金山)是这种方法的主要推动者,其“pod”系统包括 N=10 个独立的生产子单元。该系统使用一次性无菌耗材进行细胞培养。
第三种方法是为更大规模的生产而设计的。它类似于标准的工业生产线,袋子在不同站点之间的无菌转移,在这些站点发生连续生产阶段的单元操作,并且可以并行生产 N=100-1000 剂(图 7C)。这种“大型机”方法由围绕机器人公司 Multiply Labs 的一个联盟推广,Charles River 和 Thermo Fisher 最近也加入了 Cytiva 和加州大学旧金山分校的联盟。Technology Partnership(英国剑桥)也在研究自动化方法,包括使用 CellFiber 的方法(参见第 2.1 节)。最近公布的大型研究项目,如类人动物 Tesla Bot 或戴森的家用机器人,说明了这种类型的解决方案具有集成在复杂设备中执行离散操作的潜力。
所有这些系统都依赖于无菌一次性模块,这为系统和工厂设计以及重新配置带来了灵活性,同时减少了搭建和验证时间。
与主要的生物工艺工具生产商一起,Single Use Support(澳大利亚库夫施泰因)提供袋子、无菌接头和辅助产品,如无菌外壳,以在冷冻过程中保护袋子,从而支持 CGT 生产和物流过程中的大多数步骤。该公司还销售用于自体细胞疗法的自动化无菌灌装系统,可处理 36 个 0.1-1 L 袋(或通过添加额外的 36 袋“架子”而处理更多袋子)。对于无菌培养袋,Covid-19 导致全球供应链中不同点的中断而造成的痛苦,加上需求的大幅增长,增强了疗法生产商为其关键耗材寻找第二来源和理想的第三来源备用选项的价值。
无菌接头是重要的组件,可以从 Sartorius、Pall、Millipore 以及 Connectors(瑞士瓦利塞伦)或 Colder Products Company(美国密歇根州罗斯维尔)等专业公司购买。Colder Products Company 发布了一系列新的超紧凑型无菌接头(MicroCNX 系列),在连接小口径管件时无需使用管路焊接,而小口径管件通常用于采样、种子扩增链以及早期的细胞培养过程。
每种方法的优缺点
使用“N=1”盒子设施的第一种方法会导致大量重复设备。从数据生成的角度来看,这是很好的,因为多个相同的系统在不同的站点并行运行。它有利于产品开发和随后的生产规模扩展。然而,这种方法会增加成本,而且由于扩展是一个通常占用大部分总工艺时间的步骤,因此它不会实现资源的最佳利用。组件发生故障的风险可能会增加。在第二种和第三种方法中,可以引入冗余来降低失败的风险。另一方面,使用生产线方法时,生产线某处的污染可能导致该批次中正在准备的多个患者的个别剂量损失。
在部署方面,前两种“盒子”方法适用于分散生产,例如在医院或区域中心,与空运材料相比,这将简化物流并显著降低成本(特别是作为总成本的一小部分,因为其它成本预计会随着时间的推移而优化)。它还可能避免冷冻,并且会减少“静脉到静脉”的时间。这种制药模式的转变尚未完成,但是,当然,许多 CGT 患者已经受益于治疗中心在当地生产的实验性细胞疗法。从监管的角度来看,分散式生产也可能是高效的。事实上,英国药品和保健品监管机构 (MHRA) 于 2021 年就这些在护理点 (POC) 生产的药品引入新的监管框架的提议展开了磋商。这可能是世界首创的案例,需要国际协调,因为可以在许多国家轻松部署相同的 POC 生产设备。
与目标细胞治疗成本相比,盒子的资本支出 (CAPEX) 可能是可以接受的。假设一个盒子的成本为$200,000–500,000(包括维护),可以使用3–5年,每年可以生产10–20剂,那么每剂CAPEX在$2,000(200/5/20)和$16,000之间(500/3/10)。如果试剂、耗材、设施和人工成本仍然可以接受,那么它很可能被证明是为一名患者单独生产产品(如自体细胞疗法)而产生规模经济的最佳方式。事实上,当制造达10,000 个盒子(每年约 100,000-200,000 剂)将使大批量生产工具实现工业化,包括电子、电气、机械、流体和传感器,相比部署大盒子少十倍,或比生产线型系统少一百倍。
另一方面,第二种方法,尤其是第三种方法,允许资源共享,这样效率更高。此外,可以集成复杂昂贵的 PAT,甚至基于质谱或拉曼光谱的 PAT,这与分析模块的成本受到更多限制的单剂量盒子相反。第三种方法在概念上类似于大多数行业中用于大规模生产的方法,并且可能是每天要为数十万患者使用自体或异体细胞疗法时的唯一解决方案。同时,它可以依赖以前在工艺开发中手动使用的组件。这一点很重要,因为上市时间、监管和风险方面的考虑使得在临床后期转向全新的、基于盒子的集成生产系统是不切实际的,更不用说商业阶段了。自动化或半自动化的生产线系统可以相对快速地部署并逐步发展。规模放大也相对容易,因为可以在不改变生产线其余部分的情况下更换工艺流程中的组件(不像可能需要完全更换的集成盒子)。这种前向兼容性在生物学和大多数单元操作和工具仍在发展的环境中特别有价值。它也更灵活,因为它可以为特定步骤提供多种替代方法。
从软件架构的角度来看,前两种方法允许采用单一系统监督所有操作的整体方法。该系统在盒子或盒子集群级别复制。对于持续改进 (CI),数据可能会在所有系统之间共享,假设可以解决对患者数据和药物开发过程机密性的担忧。相比之下,第三种方法需要来自不同生产商的不同组件进行通信,这可能会造成复杂性和效率低下,具体取决于每个组件的实施方式。通常,机器人生产线的生产商会创建一个软件平台,每个组件和传感器都通过应用程序编程接口 (API) 连接到该平台,以便同时运行不同的软件。在所有情况下,软件的远程升级都是可行且有益的,但从监管角度来看,实施起来可能并非易事。与科技巨头的合作,例如 Moderna 和 AWS 之间的合作,可以帮助从药物发现到开发再到生产,利用云、边缘、数据和人工智能,。
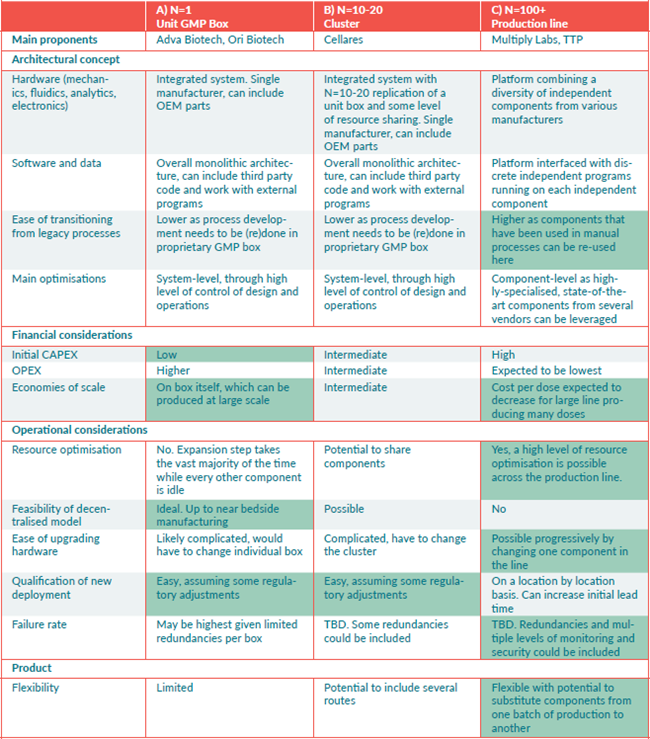
对于集成和复制的最佳水平以及我们介绍的三种方法中的最佳方法,目前还没有定论。下表 2 对比了预期的主要差异和优势。一旦部署了第一个系统,每种方法的优势和局限性的规模和影响就会变得更加明显。细胞疗法种类繁多,根据工艺过程的复杂性和适应症的普遍性,市场可能最终会被各种共存的方法分割。
表 2 三种细胞疗法生产自动化概念的预期特性。
原文:J. Sylvestre, P. Conti-Permanne, Emerging technologies & companies in cell & gene therapy manufacturing. Cell & Gene Therapy Insights 2022; 8(11), 1601–1649.






