尽管新的一次性技术提供了克服 ATMP 生产中的若干挑战所需的灵活性,但生产商在进行规模放大时必须注意许多考虑因素和障碍。
自生物药问世以来,其需求一直在增长,2020 年生物药市场价值约为 3,026.3 亿美元,预计到 2026 年将达到 5,092.3 亿美元,复合年增长率为 9.06%。随着研究和技术的进步,可用的生物药种类日益繁多,包括单克隆抗体 (mAb)、预防性疫苗、基因治疗病毒载体(主要是慢病毒和腺相关病毒)、细胞疗法(例如嵌合抗原受体 T-细胞疗法和改良干细胞)和溶瘤病毒(例如腺病毒、疱疹病毒和牛痘病毒)。
因此,生物反应器供应商和合同开发及制造组织(CDMO)行业面临着扩大生产规模的压力。为了满足需求,这些行业必须切实扩大规模,同时考虑安全性、人工操作员处理、工程、基础设施、成本,最后是生物工艺本身。
随着对产能需求的增加,一次性技术 (SUT) 与上游和下游生产业务的整合也在增加,以用于临床开发和商业供应。可用的 SUT 包括生物反应器、培养基和缓冲液制备、过程中混合和液体储存等。它们越来越多的采用主要是由 SUT 提供的许多优势推动的:
增加生产和运营
降低早期资本投资的灵活性(模块化设计)
减少总占地
缩短运行周转时间
降低运营成本
最大限度地减少交叉污染风险
实现简单的安装
提供有利于封闭工艺操作的设计
避免昂贵、费力且耗时的在线清洗/灭菌验证(后者在生产病毒时尤其具有挑战性)。
2018 年,超过 66% 的制药公司被发现更喜欢 SUT 而不是“永久性”技术。
用于先进治疗药物产品的 SUT
随着个性化医疗、孤儿药和基因治疗方式(通常被称为先进治疗药物 [ATMP])的发展,SUT 可能会越来越受欢迎。
目前有超过 1,000 种 ATMP 正在临床试验当中,且可能最终实现商业化供应。典型的重磅炸弹 mAb 药物需要非常大的生产规模,主要使用基于中国仓鼠卵巢 (CHO) 的平台工艺和不锈钢生物反应器,而 ATMP 通常需要 SUT 提供的生产和规模灵活性。
以前,不锈钢生物反应器与一次性 (SU) 生物反应器相比具有特殊优势:容量大,通常达到 10,000 - 20,000 L。大多数一次性生物反应器供应商将其产品限制在 2,000-2,500 L 规模。这部分是由于液体培养基重量增加和处理问题带来的压力挑战。
然而,在过去五年中,一次性生物反应器已经成功商业化,工作体积可达 5,000 L(ThermoFisher、HyPerforma DynaDrive) 甚至 6,000 L(ABEC Inc.)。
在需要放大至超过单个一次性生物反应器所能提供的体积的情况下,必须考虑规模扩展(增加并行生物反应器的数量)或工艺强化(通常是高细胞密度灌流工艺)。然而,并不是所有的细胞系和工艺都容易驯化或适应灌流,从而带来了额外的挑战。
确定工艺可放大性
了解和确认 ATMP 在不同规模(包括商业化规模)的生产工艺是一项关键的监管要求,可保障产品质量和患者安全。因此,适当的工艺开发、表征、放大和验证是重要的练习。
在考虑生产工艺(尤其是上游)的可放大性时,必须考虑许多重要因素。考虑这些方面是整个产品生命周期的重要组成部分,包括:
工程系统的固有可放大性(例如,生物反应器设计和关键工程参数)
生产工艺步骤
有机体的特性和特征(例如,哺乳动物细胞系,如 CHO 或 HEK293)
产生的产品(例如,mAb 或活病毒滴度)。
必须考虑的其它因素以及它们将影响的潜在因素如图 1 所示。这些包括输入考虑因素(例如 SUT 和不锈钢系统之间的选择)和输出考虑因素(包括定义关键规模缩放参数)。如果在考虑这些因素时没有花费足够的时间和精力,项目很快就会变得非常昂贵,因为它会延迟上市时间。
规模缩小模型
适当规模缩小模型的使用和确认至关重要,因为它可以降低成本并缩短时间。实验设计 (DoE) 和多变量数据分析 (MVDA) 方法的使用可用于实现更高吞吐量的工艺建模。例如,Sartorius Ambr 250 和 Ambr 15 系统分别支持多达 24 或 48 个并行化和微型化生物反应器的上游规模缩小建模。
这种规模缩小的 DoE 工作可以定义关键操作/过程/材料参数、关键控制参数/设定点和操作/可接受范围及其对产品关键质量属性的影响。提供额外的支持性、基于风险的规模放大/缩小模拟软件(Sartorius、BioPat Process Insights)可以显著减少工作量,从而缩短成功规模放大操作的时间线,并降低后期昂贵失败的风险。
上游工艺的可放大性
围绕可放大性的挑战主要涉及上游生物反应器的放大,因为与下游工艺 (DSP) 步骤的线性放大相比,这通常更为复杂。这种复杂性进一步加剧了与所选宿主细胞系相关的挑战,因为其关键性能指标对于规模放大和缩小至关重要。根据细胞系是否可以作为贴壁或悬浮生长,将极大地影响规模缩放过程中所需的考虑因素。许多一次性生物反应器在设计时都考虑到了可放大性,以缓解贴壁细胞系和悬浮细胞系上游开发中的潜在困难。
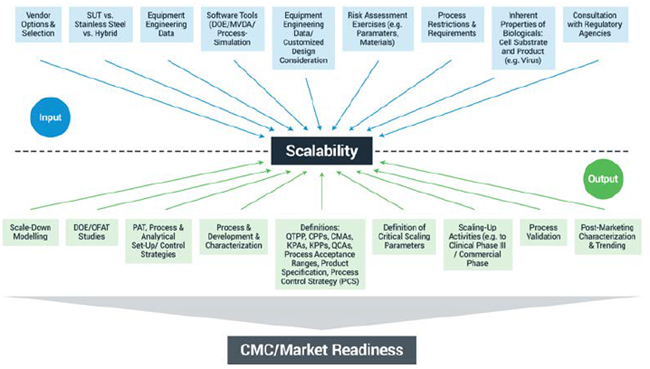
图 1. 确定工艺可放大性时的输入注意事项和潜在输出
放大悬浮细胞上游工艺
放大悬浮培养的早期阶段大多是直截了当的。摇瓶的体积范围为 125 mL 至 5 L,可对所有常用细胞系(例如 CHO-S、HEK293/T、HeLa S3)进行线性规模放大。在规模之间,工作体积通常保持恒定,典型值为 10-30%。当推进到生物反应器规模时,在扩大悬浮细胞培养规模时必须考虑几个重要参数,其中一些在表 I 中有详细说明。
当旨在创建无缝规模放大和缩小时,选择本质上设计为能够在所有可用规模之间转移工艺的生物反应器系统至关重要。
供应商通常会将他们的一次性生物反应器开发为圆柱形(尽管也有例外,例如立方体形状的 PALL),高度和直径(袋高/直径)和 d/D(叶轮直径/袋直径)的比例恒定)。具有恒定的几何设计有利于规模放大参数,例如特异性功率输入、kLa 和混合时间。
放大贴壁细胞上游工艺
贴壁细胞培养的规模放大以前并不容易,并且依赖于可放大的、基于微载体的工艺的扩展和开发。
横向规模扩展涉及增加培养单元的数量(例如,T瓶、滚瓶、CellSTACK [康宁])。与规模放大技术相比,规模扩展需要大量的操作员操作,并且存在固有的高污染风险。操作挑战也经常出现,因为某些主要与细胞相关的工艺参数必须仔细考虑和控制。放大基于微载体的工艺也不是一件容易的事,并不适合所有细胞系和产品组合(例如,对某些病毒来说很困难)。
幸运的是,一次性封闭操作和线性可放大的固定床生物反应器系统现已进入市场空间,供应商包括 PALL (iCELLis)、Univercells Technologies (scale-X) 和 Corning (ASCENT)。这些系统的工程设计通常旨在实现无缝规模放大,同时考虑剪切应力、功率输入、单位生长表面积的培养基体积以及供氧能力等因素。
所有三种生物反应器都提供用于概念验证、工艺建立和表征的的规模缩小开发和建模系统。最大的GMP生产规模包括 500 m2 (PALL)、600 m2 (Univercells Technologies) 和 1,000 m2 (Corning)。
DSP 步骤的可放大性
大多数典型的下游工艺允许线性规模放大/缩小。DSP 中的许多工艺都依赖于一次性组件,包括过滤器和层析填料。生产商在使用这些一次性技术时必须意识到 DSP 步骤规模放大中的挑战,包括识别供应商提供各种规模的技术的能力(特别是对于规模缩小模型)。还必须考虑确定某些一次性技术产品是更适合横向规模扩展还是纵向规模放大。
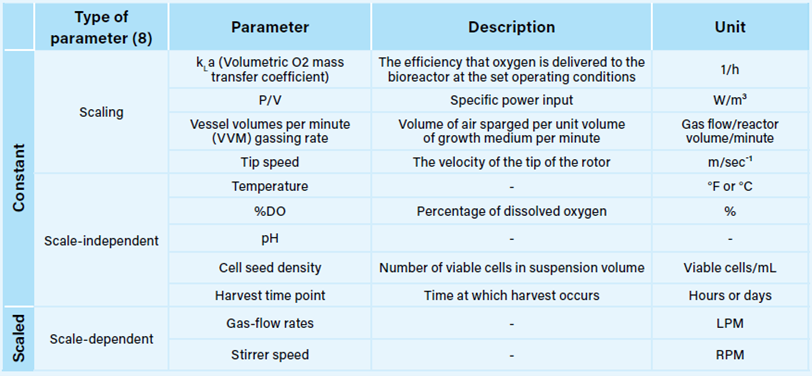
表 I. 悬浮细胞培养规模放大时必须考虑的关键常数和缩放参数
直流过滤
直流过滤 (NFF) 操作通常在 DSP 中用于在收获时进行澄清或在工艺流程的最后阶段用于减少生物负荷和终端除菌过滤目的。此类过滤器提供单一孔径截留膜,或一系列具有从大到小“漏斗”功能的截留膜,以提高过滤能力。
NFF 可以在恒定压力或恒定通量 [LMH;升/平方米/小时]条件下进行,且产品的潜在剪切应力必须始终考虑在内。规模缩放时,供应商、膜材质和孔径应保持不变。
膜面积和处理体积应与工艺进料体积成线性比例,由此污染物在不同工艺运行和生产规模之间被视为具有可比性。还应考虑可堆叠(即可并联)过滤元件,因为它可以在可用膜面积上提供更大的灵活性,覆盖比独立囊式滤器更大的规模。
错流/切向流过滤。
在错流/切向流过滤 (CFF/TFF) 中,进料以水平液流的形式流过膜;因此,通常可以降低滤膜污染的倾向。关键优化参数是通量 (LMH),其与 TMP (bar) 相关。常用的形式是中空纤维组件或平板膜包。
截留分子量 (MWCO) 是一个重要参数,应仔细考虑要去除的污染物的分子量和产品粒径本身。所有规模条件下的 MWCO 必须保持恒定。
CFF 使用恒定的跨膜压力或滤液通量 FLUX 进行控制。在规模放大过程中,过滤器负载(单位面积的处理体积)保持稳定。切向流速通常通过保持剪切率恒定而按比例增加。这对于剪切敏感产品(例如,囊膜病毒)是有意义的。
层析。大多数生物生产过程包括至少一个结合/漂洗/洗脱或流穿方式的层析步骤,以富集产品并去除与工艺相关的残留物。
最常用的模式是亲和、离子交换、尺寸排阻、疏水相互作用和复合模式填料。规模放大时,关键的线性缩放参数是流速 (cm/h) 或产品保留时间。为保持不同规模的流速恒定,应通过保持柱高恒定并增加柱直径,使柱体积与要上样的体积成线性比例增加。
所有缓冲液的体积也应线性缩放,通量率保持恒定(柱体积/小时)。层析柱体积的线性放大并不总是能简单实现,因为层析柱、膜吸附或整体柱只以特定尺寸提供。
缓解这一问题的选项可以是运行多个产品循环或并行化处理。按恒定柱体积/小时进行放大被用作替代方法,并可能成为某些模式(例如亲和、离子交换)的行业标准,有助于避免运行过程超出柱处理量。
规模扩展 vs. 规模放大
改变现有设施的规模,例如天花板高度、高压灭菌柜容量、地板重量负载、气体供应能力、液体处理单元和种子扩增链的变化可能会带来重大挑战。因此,规模扩展通常被视为比向上规模放大更可行的替代方案,可提供生产灵活性并更好地适应市场波动。SUT 特别适合这种策略。
工艺验证也更直接;通过使用框架验证设计,不需要额外的验证。横向规模扩展生产还意味着,如果发生故障(取决于根本原因),整批产品不会丢失,而只会丢失一个单元。随着现在有更多选项可用于成功的工艺强化,横向规模扩展已成为对 ATMP 生产商越来越有吸引力的选择。
关键知识
在放大 ATMP 生产工艺时,必须考虑许多重要的因素,以提供灵活性和可放大性。SUT 非常适合 ATMP 生产,尤其是在横向规模扩展时。随着 SUT 的进步及其不同尺寸的可用性,这些技术的采用可能会变得越来越流行。然而,生产商在使用 SUT 进行规模扩展时仍将面临挑战,并且需要了解和考虑可能会在不断变化的规模上受到影响的所有工艺参数。
原文:K.Lipinski, Scaling Manufacturing Processes Using Single-Use Technologies. Pharmaceutical technology, 2023.






